题目内容
【题目】顺—1,2—二甲基环丙烷和反—1,2—二甲基环丙烷可发生如下转化:

该反应的速率方程可表示为:v(正)=k(正)·c(顺)和v(逆)=k(逆)·c(反),k(正)和k(逆)分别称作正、逆反应速率常数,它们受温度和催化剂影响。下列有关说法正确的是( )
A.某温度时,该反应的平衡常数可表示为K=![]()
B.正、逆反应速率常数改变,平衡常数也一定会随之改变
C.若升高温度,平衡逆向移动,则说明正反应的活化能高于逆反应的活化能
D.催化剂可以改变反应速率但不影响平衡,说明催化剂同等程度改变k(正)和k(逆)
【答案】D
【解析】
A.平衡时正逆反应速率相等,v(正)=k(正)c(顺)=v(逆)=k(逆)c(反),K为生成物浓度幂之积与反应物浓度幂之积的比,则K=![]() ,故A错误;
,故A错误;
B.k(正)和k(逆)分受温度和催化剂影响,K只受温度的影响,则正、逆反应速率常数改变,平衡常数不一定变化,故B错误;
C.若升高温度,平衡逆向移动,正反应为放热反应,焓变小于零,焓变=正反应活化能-逆反应活化能,则正反应的活化能小于逆反应的活化能,故C错误;
D.催化剂可以改变反应速率但不影响平衡,即K=![]() 不变,因此催化剂同等程度改变k(正)和k(逆),故D正确;
不变,因此催化剂同等程度改变k(正)和k(逆),故D正确;
故选:D。

【题目】如图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是
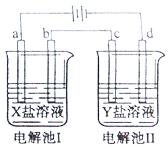
选项 | X | Y |
A. | CuSO4 | AgNO3 |
B. | AgNO3 | NaCl |
C. | FeSO4 | Al2(SO4)3 |
D. | MgSO4 | CuSO4 |
A.AB.BC.CD.D
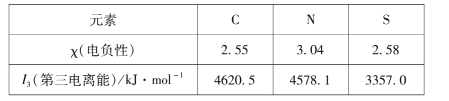
【题目】运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)反应ⅠFe(s)+CO2(g) ![]() FeO(s)+CO(g) ΔH1,平衡常数为K1;
FeO(s)+CO(g) ΔH1,平衡常数为K1;
反应ⅡFe(s)+H2O(g) ![]() FeO(s)+H2(g) ΔH2,平衡常数为K2;
FeO(s)+H2(g) ΔH2,平衡常数为K2;
在不同温度K1、K2值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①由表中判断,反应Ⅰ为中ΔH1______ (填“<”或“=”或“>”) 0。
②反应CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH平衡常数为K,则K=________(用K1和K2表示)。
CO(g)+H2O(g) ΔH平衡常数为K,则K=________(用K1和K2表示)。
③能判断CO2(g)+H2(g) ![]() CO(g)+H2O(g)达到化学平衡状态的依据是________(填字母)。
CO(g)+H2O(g)达到化学平衡状态的依据是________(填字母)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
E.容器内的气体密度不变 F.混合气体的平均摩尔质量不变。
(2)在不同温度和压强下合成氨,起始时投入氮气和氢气的物质的量分别为1mol、3mol。平衡时混合物中氨的体积分数与温度的关系如图。
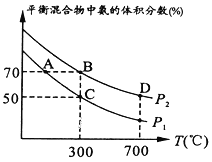
①P1_______P2 (填“>”“=” “<”或“不确定”,)。
②C点H2的转化率为________。