题目内容
9.下列四幅图中,小白球代表的是氢原子,大灰球代表的是氦原子.最适合表示同温同压下,等质量的氢气与氦气的混合气体的图示是( )| A. |  | B. | 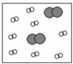 | C. |  | D. | 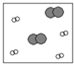 |
分析 如图表示氦分子与氢气分子的数量关系,分子数之比等于该物质的物质的量之比,根据n=$\frac{m}{M}$判断等质量的氢气与氦气的物质的量之比,注意稀有气体是单原子分子.
解答 解:氦气的摩尔质量为4g/mol.氢气的摩尔质量为2g/mol,
设质量为4g,则氦气的物质的量为:$\frac{4g}{4g/mol}$=1mol,
氢气的物质的量为:$\frac{4g}{2g/mol}$=2mol,
所以氢气分子与氦气分子的分子数之比为:2mol:1mol=2:1,
稀有气体为单原子分子,故B、D错误;
A中氢气与氦气的物质的量之比为1:1,C中为2:1,
故选C.
点评 本题考查学生对信息的提取以及阿伏伽德罗定律的利用,题目难度不大,明确气体为单原子为分子为解答关键,注意掌握阿伏伽德罗定律及其推论的内容.

练习册系列答案
相关题目
14.现有6瓶失去标签的液体,已知它们可能是乙醇、乙酸、苯、乙酸乙酯、油脂、葡萄糖中的一种.现通过如下实验来确定各试剂瓶中所装液体的名称:
(1)A的俗名为酒精,B中所含官能团的名称为羧基. D的结构简式为CH3COOCH2CH3.
(2)在D中加入NaOH溶液并加热的化学方程式为CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH.
(3)C的二氯代物有三种同分异构体;
(4)若将1mol乙醇(其中的羟基氧用18O标记)在浓硫酸存在下并加热与足量乙酸充分反应.则生成的乙酸乙酯的质量大于88g(填:大于,小于或等于)
(5)已知乙醛发生银镜反的方程式为:CH3CHO+2Ag(NH3)2OH$\stackrel{加热}{→}$CH3COONH4+H2O+2Ag↓+3NH3,试写出葡萄糖发生银镜反应的化学方程式CH2OH(CHOH)4CHO+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$CH2OH(CHOH)4COONH4+2Ag↓+H2O+3NH3.
| 实验步骤和方法 | 实验现象 |
| ①把6瓶液体分别依次标号A、B、C、D、E、F,然后闻气味 | 只有F没有气味 |
| ②各取少量于试管中,加水稀释 | 只有C、D、E不溶解而浮在水面上 |
| ③分别取少量6种液体于试管中,加新制Cu(OH)并加热 | 只有B使沉淀溶解,F中产生砖红色沉淀 |
| ④各取C、D、E少量于试管中,加稀NaOH溶液并加热 | 只有C仍有分层现象,且在D的试管中闻到特殊香味 |
(2)在D中加入NaOH溶液并加热的化学方程式为CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH.
(3)C的二氯代物有三种同分异构体;
(4)若将1mol乙醇(其中的羟基氧用18O标记)在浓硫酸存在下并加热与足量乙酸充分反应.则生成的乙酸乙酯的质量大于88g(填:大于,小于或等于)
(5)已知乙醛发生银镜反的方程式为:CH3CHO+2Ag(NH3)2OH$\stackrel{加热}{→}$CH3COONH4+H2O+2Ag↓+3NH3,试写出葡萄糖发生银镜反应的化学方程式CH2OH(CHOH)4CHO+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$CH2OH(CHOH)4COONH4+2Ag↓+H2O+3NH3.
18.一定量的Al2(SO4)3,ZnSO4,Na2SO4三种溶液分别与足量BaCl2溶液反应.若生成BaSO4沉淀质量比为1:2:3,则三种硫酸盐溶液的物质的量比为( )
| A. | 1:6:9 | B. | 1:2:3 | C. | 1:3:3 | D. | 1:3:6 |
 或
或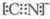 ;
;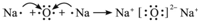 .
.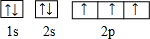 ,这样的排布遵循了泡利原理和洪特规则.
,这样的排布遵循了泡利原理和洪特规则.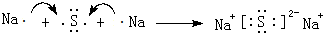 .
.
 .
.