题目内容
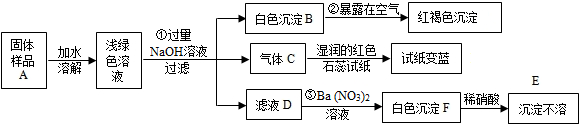
18.一定量的Al2(SO4)3,ZnSO4,Na2SO4三种溶液分别与足量BaCl2溶液反应.若生成BaSO4沉淀质量比为1:2:3,则三种硫酸盐溶液的物质的量比为( )| A. | 1:6:9 | B. | 1:2:3 | C. | 1:3:3 | D. | 1:3:6 |
分析 均发生硫酸根离子与钡离子的反应,生成BaSO4沉淀质量比为1:2:3,则生成BaSO4沉淀的物质的量比为1:2:3,结合硫酸根离子守恒计算.
解答 解:生成BaSO4沉淀质量比为1:2:3,则生成BaSO4沉淀的物质的量比为1:2:3,
设Al2(SO4)3、ZnSO4、Na2SO4的物质的量分别为x、y、z,
则3x:y:z=1:2:3,
解得x:y:z=1:6:9,
故选A.
点评 本题考查化学反应的计算,为高频考点,把握发生的离子反应及硫酸根离子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案
相关题目
6.NH3和NO2在催化剂作用下反应:8NH3+6NO2═7N2+12H2O.若还原产物比氧化产物少0.1mol,则下列判断正确的是( )
| A. | 转移电子4.8NA个 | B. | 生成气体的体积42.56L(标准状况) | ||
| C. | 还原剂比氧化剂多0.2mol | D. | 被还原的氮原子是11.2g |
3.NA表示阿伏德罗常数的额值,下列说法正确的是( )

| A. | 5.6g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| B. | 12.5mL 16mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA | |
| C. | 7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA | |
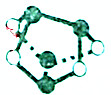
| D. | 0.5mol雄黄(As4S4,结构如图),含有NA个As-S键 |
10.下列关于物质的量浓度表述正确的是( )
| A. | 0.3mol•L-1 的Na2SO4溶液中含有Na+和SO42-的总物质的量为0.9mol | |
| B. | 当1L水吸收22.4L氨气时所得氨水的浓度不是1mol•L-1,只有当22.4L氨气溶于水制得1L氨水时,其浓度才是1mol•L-1 | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相等 | |
| D. | 10℃时,0.35mol/L的KCl饱和溶液100mL蒸发掉5g水,冷却到10℃时,其体积小于100mL,它的物质的量浓度仍为0.35mol/L |