题目内容
19.海水中通入空气为什么会生成酸性物质.分析 海水中通入空气,二氧化碳和水反应生成碳酸,溶液显酸性.
解答 解:海水中通入空气,二氧化碳和水反应生成碳酸,CO2+H2O=H2CO3,生成酸性物质为碳酸,
答:二氧化碳和水反应生成碳酸,CO2+H2O=H2CO3,生成酸性物质为碳酸.
点评 本题考查了物质性质的理解应用,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
10.下列关于物质的量浓度表述正确的是( )
| A. | 0.3mol•L-1 的Na2SO4溶液中含有Na+和SO42-的总物质的量为0.9mol | |
| B. | 当1L水吸收22.4L氨气时所得氨水的浓度不是1mol•L-1,只有当22.4L氨气溶于水制得1L氨水时,其浓度才是1mol•L-1 | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相等 | |
| D. | 10℃时,0.35mol/L的KCl饱和溶液100mL蒸发掉5g水,冷却到10℃时,其体积小于100mL,它的物质的量浓度仍为0.35mol/L |
4.用NA表示表示阿伏伽德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,0.05NA个CO2分子所占的体积是1.12L | |
| B. | 1mol 氧气所含有的原子数为NA | |
| C. | 常温常压下,32g O2和34g H2S气体分子个数比为1:1 | |
| D. | 11.2L NH3中所含的质子数为5NA |
1.在实验室里可用右图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质.
图甲中:①为氯气发生装置;②的试管里盛有15mL 30% KOH溶液,并置于热水浴中;③的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置.
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗(填写仪器名称)向烧瓶中加入适量的浓盐酸.实验室制Cl2的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有C(填写下列编号字母)的净化装置.
A.碱石灰 B.氢氧化钠溶液 C.饱和食盐水 D.浓硫酸
(2)如果将过量二氧化锰与20mL 12mol•L-1的浓盐酸混合加热,充分反应后生成的氯气明显少于0.06mol.其主要原因有:①浓盐酸挥发变稀,②反应一段时间后,浓盐酸消耗变稀,无法被二氧化锰氧化.
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是
①制取温度不同,制取氯酸钾需要较高温度,制取次氯酸钠需要较低温度;
②制取时,碱的浓度也不同,制取氯酸钾需要浓度较大的碱,制取次氯酸钠需要浓度较小的碱.
反应完毕经冷却后,②的试管中有大量晶体析出.图乙中符合该晶体溶解度曲线的是M(填写编号字母);
从②的试管中分离出该晶体的方法是过滤(填写实验操作名称).
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白.

图甲中:①为氯气发生装置;②的试管里盛有15mL 30% KOH溶液,并置于热水浴中;③的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置.
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗(填写仪器名称)向烧瓶中加入适量的浓盐酸.实验室制Cl2的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有C(填写下列编号字母)的净化装置.
A.碱石灰 B.氢氧化钠溶液 C.饱和食盐水 D.浓硫酸
(2)如果将过量二氧化锰与20mL 12mol•L-1的浓盐酸混合加热,充分反应后生成的氯气明显少于0.06mol.其主要原因有:①浓盐酸挥发变稀,②反应一段时间后,浓盐酸消耗变稀,无法被二氧化锰氧化.
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是
①制取温度不同,制取氯酸钾需要较高温度,制取次氯酸钠需要较低温度;
②制取时,碱的浓度也不同,制取氯酸钾需要浓度较大的碱,制取次氯酸钠需要浓度较小的碱.
反应完毕经冷却后,②的试管中有大量晶体析出.图乙中符合该晶体溶解度曲线的是M(填写编号字母);
从②的试管中分离出该晶体的方法是过滤(填写实验操作名称).
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白.
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成次氯酸具有漂白性 |
| 然后溶液从无色逐渐变为浅黄绿色 | 过量氯气溶解于水中 |
19.(1)下表是A、B二种有机物的有关信息:
根据表中信息回答下列问题:
①A与溴的四氯化碳溶液反应的生成物的名称是1,2-二溴乙烷;写出在一定条件下,A生成高分子化合物的化学反应方程式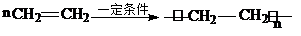 .
.
②A与氢气发生加成反应后生成分子C,与C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
③B具有的性质是bc(填序号)
a.无色无味液体 b.有毒 c.不溶于水 d.密度比水大
e.能使酸性KMnO4溶液和溴水褪色 f.任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:C6H6+HNO3$→_{△}^{浓硫酸}$C6H5NO2+H2O.
(2)二恶英是严重的污染物,很难降解,毒性极大,它常由焚烧垃圾产生,其中一种异构体为 ,它的分子式为C12H4Cl4,它是属于芳香族化合物(填“是”或“否”)
,它的分子式为C12H4Cl4,它是属于芳香族化合物(填“是”或“否”)
| A | B |
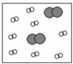
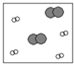
| ①能使溴的四氯化碳溶液褪色; ②比例模型为:  ③能与水在一定条件下反应 | ①由C、H两种元素组成; ②球棍模型为: 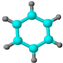 |
①A与溴的四氯化碳溶液反应的生成物的名称是1,2-二溴乙烷;写出在一定条件下,A生成高分子化合物的化学反应方程式
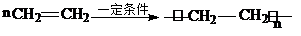 .
.②A与氢气发生加成反应后生成分子C,与C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
③B具有的性质是bc(填序号)
a.无色无味液体 b.有毒 c.不溶于水 d.密度比水大
e.能使酸性KMnO4溶液和溴水褪色 f.任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:C6H6+HNO3$→_{△}^{浓硫酸}$C6H5NO2+H2O.
(2)二恶英是严重的污染物,很难降解,毒性极大,它常由焚烧垃圾产生,其中一种异构体为
 ,它的分子式为C12H4Cl4,它是属于芳香族化合物(填“是”或“否”)
,它的分子式为C12H4Cl4,它是属于芳香族化合物(填“是”或“否”)