题目内容
17.A、B、C、D是四种短周期元素,E是第四周期金属元素.A、B、D同周期,C、D同主族,A原子的M电子层上有两个单电子且有空的p轨道,B是同周期电负性最小的元素,一个C原子有7种不同运动状态的电子.回答下列问题:(1)写出下列元素的符号:AS BNa CN DP
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是HNO3,碱性最强的是NaOH.
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是Cl,电负性最大的元素是Cl.
(4)D的氢化物比C的氢化物的沸点NH3(填“高“或“低“),原因NH3分子之间存在氢键.
(5)E元素的单质及合金在生产生活中应用很广泛,是重要的建筑材料,则其原子的核电荷数是26,E元素在周期表的第Ⅷ族,已知元素周期表可按电子排布分为s区、p区等,则E元素在d区,E原子的外围电子排布式为3d64s2.
(6)A、B、C最高价氧化物的晶体类型分别是分子晶体、离子晶体、分子晶体.
(7)画出C的核外电子排布图
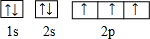 ,这样的排布遵循了泡利原理和洪特规则.
,这样的排布遵循了泡利原理和洪特规则.(8)用电子式表示B的硫化物的形成过程:
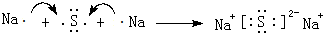 .
.
分析 (1)A、B、C、D是四种短周期元素,A原子的M电子层上有两个单电子且有空的p轨道,M层电子排布式为3s23p4,故A为S元素;A、B、D同周期,即处于第三周期,B是同周期电负性最小的元素,处于IA族,故B为Na;一个C原子有7种不同运动状态的电子,则C为N元素;C、D同主族,则D为P元素;
(2)非金属性越强,最高价氧化物对应水化物的酸性越强,金属性越强,最高价氧化物对应水化物的碱性越强;
(3)同周期随原子序数增大,第一电离能呈增大趋势,但ⅡA族、ⅤA族元素第一电离能高于同周期相邻元素;同周期随原子序数增大,电负性增大;
(4)氨气分子之间存在氢键,沸点较高;
(5)E是第四周期金属元素,E元素的单质及合金在生产生活中应用很广泛,是重要的建筑材料,则E为Fe;
(6)A、B、C最高价氧化物分别为SO3、Na2O、N2O5,分别是分子晶体、离子晶体、分子晶体,
(7)C为N元素,根据泡利原理和洪特规则画出核外电子排布图;
(8)B的硫化物为Na2S,由钠离子与硫离子构成.
解答 解:A、B、C、D是四种短周期元素,A原子的M电子层上有两个单电子且有空的p轨道,M层电子排布式为3s23p4,故A为S元素;A、B、D同周期,即处于第三周期,B是同周期电负性最小的元素,处于IA族,故B为Na;一个C原子有7种不同运动状态的电子,则C为N元素;C、D同主族,则D为P元素;E是第四周期金属元素,(5)中E元素的单质及合金在生产生活中应用很广泛,是重要的建筑材料,则E为Fe.
(1)由上述分析可知,A为S、B为Na、C为N、D为P,故答案为:S;Na;N;P;
(2)上述五种元素中,最高价氧化物对应水化物酸性最强的是HNO3,碱性最强的是NaOH,故答案为:HNO3;NaOH;
(3)D所在周期(除稀有气体元素外)为第三周期,同周期随原子序数增大,第一电离能呈增大趋势,但ⅡA族、ⅤA族元素第一电离能高于同周期相邻元素,故第一电离能最大的元素是Cl,同周期随原子序数增大,电负性增大,故电负性最大的元素是Cl,故答案为:Cl;Cl;
(4)D、C的氢化物分别为PH3、NH3,由于NH3分子之间存在氢键,故沸点:PH3<NH3,故答案为:NH3;NH3分子之间存在氢键;
(5)E是第四周期金属元素,E元素的单质及合金在生产生活中应用很广泛,是重要的建筑材料,则E为Fe,其原子的核电荷数是26,E元素在周期表的第Ⅷ族,位于d区,原子的外围电子排布式为3d64s2,
故答案为:26;Ⅷ;d;3d64s2;
(6)A、B、C最高价氧化物分别为SO3、Na2O、N2O5,晶体类型分别是分子晶体、离子晶体、分子晶体,
故答案为:分子;离子;分子;
(7)C为N元素,原子核外电子排布图 ,这样的排布遵循了泡利原理和洪特规则,
,这样的排布遵循了泡利原理和洪特规则,
故答案为: ;泡利;洪特;
;泡利;洪特;
(8)B的硫化物为Na2S,用电子式表示形成过程: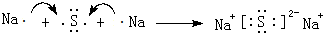 ,
,
故答案为: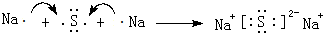 .
.
点评 本题考查结构性质位置关系综合应用,推断元素是解题关键,侧重对位置结构的考查,注意用电子式表示物质或化学键的形成,难度中等.

| A. | 阿伏加德罗常数就是6.02×1023 | |
| B. | 物质的量是一物理量,表示含有一定数目粒子的集体 | |
| C. | 摩尔是七个基本物理量之一 | |
| D. | 摩尔既是物质的量的单位,又是粒子的数量单位 |
| A. | 转移电子4.8NA个 | B. | 生成气体的体积42.56L(标准状况) | ||
| C. | 还原剂比氧化剂多0.2mol | D. | 被还原的氮原子是11.2g |
 ,化学键类型为共价键;
,化学键类型为共价键;