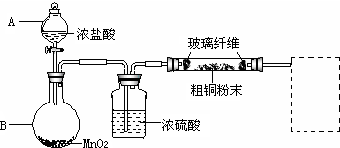
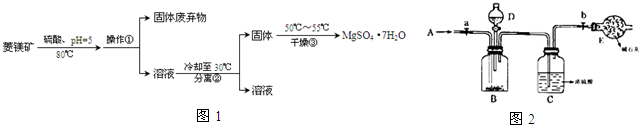
题目内容
5.氮化硅( Si3N4)是一种优良的高温结构陶瓷,在工业生产和科技领域有重要用途.Ⅰ.工业上有多种方法来制备氮化硅,常见的方法有:
方法一:直接氮化法:在1300℃-1400℃时,高纯粉状硅与纯氮气化合,其反应方程式为3Si+2N2$\frac{\underline{\;1300℃-1400℃\;}}{\;}$Si3N4.
方法二:化学气相沉积法:在高温条件下利用四氯化硅气体、纯氮气、氢气反应生成氮化硅和HC1,与方法一相比,用此法制得的氮化硅纯度较高,其原因是方法一所得到的产品中混有单质硅,而方法二除产品是固体,其他物质均为气体.
方法三:Si(NH2)4热分解法:先用四氯化硅与氨气反应生成Si(NH2)4和-种气体(填分子式)HCl;然后使Si(NH2)4受热分解,分解后的另一种产物的分子式为NH3 .
Ⅱ.工业上制取高纯硅和四氯化硅的生产流程如下:
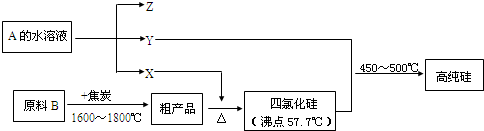
已知:X、高纯硅、原料B的主要成分都可与Z反应,Y,与X在光照或点燃条件下可反应,Z的焰色呈黄色.
(1)原料B的主要成分是(写名称)二氧化硅.
(2)写出焦炭与原料B中的主要成分反应的化学方程式:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(3)上述生产流程中电解A的水溶液时,阳极材料能否用Cu不能;(填“能”或“不能”),写出Cu为阳极电解A的水溶液开始一段时间阴阳极的电极方程式:
阳极:Cu-2e-=Cu2+;阴极:2H2O+2e-=H2↑+2OH-.
分析 I、方法一:硅与纯氮气在高温条件下发生化合反应生成氮化硅;
方法二:方法一所得到的产品中可能混有反应物单质硅,而方法二除产品是固体,其他物质均为气体;
方法三:根据反应中原子守恒规律判断四氯化硅与氨气反应生成的气体,判断Si(NH2)4受热分解生成的产物,据此解答;
Ⅱ、原料B与碳得到粗产品与X反应,生成SiCl4,Si+2Cl2$\frac{\underline{\;高温\;}}{\;}$SiCl4,则X为氯气,原料B与碳得到粗产品为Si,焦炭与SiO2反应生成Si与CO,反应方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,故B为SiO2,Y与氯气在光照或点燃条件下可反应,且与SiCl4反应得到高纯度Si,SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$4HCl+Si,则Y为氢气.Z的焰色呈黄色,含有Na元素,电解A得到氢气、氯气与Z,则Z为NaOH、A为NaCl,电解NaCl溶液离子反应为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,据此解答.
解答 解:I、方法一:硅与纯氮气反应的化学方程式为:3Si+2N2$\frac{\underline{\;1300℃-1400℃\;}}{\;}$Si3N4,
故答案为:3Si+2N2$\frac{\underline{\;1300℃-1400℃\;}}{\;}$Si3N4;
方法二:方法一所得到的产品中混有单质硅,而方法二除产品是固体,其他物质均为气体,故方法二得到氮化硅纯度较高;
故答案为:方法一所得到的产品中混有单质硅,而方法二除产品是固体,其他物质均为气体;
方法三:依据化学反应中原子个数守恒可知四氯化硅与氨气反应:3SiCl4+4NH3=Si3N4+12HCl,依据化学反应中原子个数守恒可知3Si(NH2)4$\frac{\underline{\;\;△\;\;}}{\;}$Si3N4+8NH3 ,
故答案为:HCl;NH3 .
Ⅱ、原料B与碳得到粗产品与X反应,生成SiCl4,则X为氯气,原料B与碳得到粗产品为Si,故B为SiO2.Y与氯气在光照或点燃条件下可反应,且与SiCl4反应得到高纯度Si,则Y为氢气.Z的焰色呈黄色,含有Na元素,电解A得到氢气、氯气与Z,则Z为NaOH、A为NaCl.
(1)原料B与碳得到粗产品为Si,焦炭与SiO2反应生成Si与CO,反应方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,故B为SiO2,名称为二氧化硅,
故答案为:二氧化硅;
(2)焦炭具有还原性,与SiO2发生氧化还原反应,生成Si与CO,反应方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(3)电解饱和食盐水,在阳极上是氯离子失电子的氧化反应:2Cl--2e-=Cl2↑,阴极上是氢离子得电子的还原反应:2H++2e-=H2↑,总反应是:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2NaOH,阳极材料若为Cu,则Cu放电,氯离子不能放电生成氯气,故阳极材料不能为Cu;Cu为阳极电解NaCl的水溶液开始一段时间,阳极Cu放电生成铜离子,阳极电极反应式为:Cu-2e-=Cu2+,阴极水放电生成氢气与氢氧根离子,阴极电极反应式为:2H2O+2e-=H2↑+2OH-,
故答案为:不能;Cu-2e-=Cu2+;2H2O+2e-=H2↑+2OH-.
点评 本题考查工业上制取氮化硅的制取、高纯硅和四氯化硅,涉及化学工艺流程、无机物推断、电解原理等,有利用学生能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.

| A. | 化学反应除了生成新物质外,还伴随着能量的变化 | |
| B. | 放热反应都不需要加热就能发生 | |
| C. | 吸热反应在一定条件(如常温、加热等)也能发生 | |
| D. | 化学反应是放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量的大小 |
| A. | 稀硫酸滴在镁片上:Mg+2H+═Mg2++H2↑ | |
| B. | 硫酸镁溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 硝酸银溶液与盐酸反应:Ag++Cl-═AgCl↓ | |
| D. | 澄清石灰水与碳酸钠溶液反应:Ca(OH)2+CO32-═CaCO3↓+H2O |
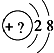 某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.
某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断. ;
;