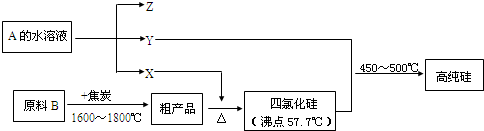
题目内容
14.下列离子方程式正确的是( )| A. | 稀硫酸滴在镁片上:Mg+2H+═Mg2++H2↑ | |
| B. | 硫酸镁溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 硝酸银溶液与盐酸反应:Ag++Cl-═AgCl↓ | |
| D. | 澄清石灰水与碳酸钠溶液反应:Ca(OH)2+CO32-═CaCO3↓+H2O |
分析 A.反应生成硫酸镁和氢气;
B.漏写生成氢氧化镁的离子反应;
C.反应生成氯化银和硝酸;
D.石灰水中氢氧化钙完全电离.
解答 解:A.稀硫酸滴在镁片上的离子反应为Mg+2H+═Mg2++H2↑,故A正确;
B.硫酸镁溶液与氢氧化钡溶液反应的离子反应为Mg2++2OH-+Ba2++SO42-═BaSO4↓+Mg(OH)2↓,故B错误;
C.硝酸银溶液与盐酸反应的离子反应为Ag++Cl-═AgCl↓,故C正确;
D.澄清石灰水与碳酸钠溶液反应的离子反应为Ca2++CO32-═CaCO3↓,故D错误;
故选AC.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
3.人体内存在着酸碱平衡,如出现失衡将对人体健康产生极大危害.人体内生成的下列酸属于无机物的是( )
| A. | 乳酸(C3H6O3) | B. | 磷酸(H3PO4) | C. | 丙酮酸(C3H4O3) | D. | 乙酰乙酸(C4H6O3) |
2.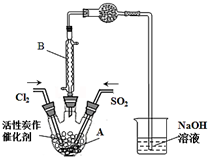 某学习小组依据反应:SO2(g)+Cl2(g?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
某学习小组依据反应:SO2(g)+Cl2(g?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
(1)若用浓盐酸与二氧化锰为原料制取Cl2,反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)B仪器的作用是使挥发的产物SO2Cl2冷凝回流.
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择a.
a.冰水浴 b.常温 c.加热至69.1℃
(4)如果通入的Cl2或SO2含有水蒸气,氯气和二氧化硫可能发生反应的化学方程式为SO2+Cl2+2H2O═H2SO4+2HCl.
(5)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应.充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收.分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W.
①经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式SO2Cl2+2H2O=H2SO4+2HCl.
②无色溶液W中的阴离子除含少量OH-外,还含有其它两种阴离子,检验溶液W中这两种阴离子方法是取少量W溶液于试管中,加入过量Ba(NO3)2溶液,有不溶于稀硝酸的白色沉淀产生,说明溶液中含有SO42-,过滤,向滤液中滴加HNO3酸化,再加入AgNO3溶液,产生白色沉淀,则说明溶液中有Cl-.
③反应完成后,在W溶液、烧杯中分别滴加过量的BaCl2溶液,均出现白色沉淀,此沉淀不溶于稀盐酸,经过滤、洗涤、干燥,称量得到的固体质量分别为xg、yg.计算SO2+Cl2?SO2Cl2反应中,SO2的转化率$\frac{X}{X+Y}$×100%(用含x、y的代数式表示).
 某学习小组依据反应:SO2(g)+Cl2(g?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
某学习小组依据反应:SO2(g)+Cl2(g?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.| SO2Cl2 | Cl2 | SO2 | |
| 熔点/℃ | -54.1 | -101 | -72.4 |
| 沸点/℃ | 69.1 | -34.6 | -10 |
| 性质 | 遇水发生剧烈 |
(2)B仪器的作用是使挥发的产物SO2Cl2冷凝回流.
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择a.
a.冰水浴 b.常温 c.加热至69.1℃
(4)如果通入的Cl2或SO2含有水蒸气,氯气和二氧化硫可能发生反应的化学方程式为SO2+Cl2+2H2O═H2SO4+2HCl.
(5)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应.充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收.分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W.
①经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式SO2Cl2+2H2O=H2SO4+2HCl.
②无色溶液W中的阴离子除含少量OH-外,还含有其它两种阴离子,检验溶液W中这两种阴离子方法是取少量W溶液于试管中,加入过量Ba(NO3)2溶液,有不溶于稀硝酸的白色沉淀产生,说明溶液中含有SO42-,过滤,向滤液中滴加HNO3酸化,再加入AgNO3溶液,产生白色沉淀,则说明溶液中有Cl-.
③反应完成后,在W溶液、烧杯中分别滴加过量的BaCl2溶液,均出现白色沉淀,此沉淀不溶于稀盐酸,经过滤、洗涤、干燥,称量得到的固体质量分别为xg、yg.计算SO2+Cl2?SO2Cl2反应中,SO2的转化率$\frac{X}{X+Y}$×100%(用含x、y的代数式表示).
9. 盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.
盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.
已知室温下:Ka(CH3COOH)=1.7×10-5 mol•L-1;H2CO3的电离常数Ka1=4.2×10-7mol•L-1、Ka2=5.6×10-11mol•L-1
(1)常温下,物质的量浓度相同的下列四种溶液:a、氢氧化钡溶液b、氢氧化钠溶液c、碳酸钠溶液d、碳酸氢钠溶液e、醋酸钠溶液.其PH由大到小的顺序是:a>b>c>d>e(填序号).
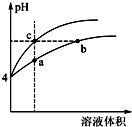
(2)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是b=c>a;该醋酸溶液稀释过程中,下列各量一定变小的是ad.
a.c(H+) b.c(OH-) c.$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$ d.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$
(3)以0.10mol•L-1NaOH为标准液,测定某盐酸的浓度.取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
①滴定达到终点的标志是最后一滴NaOH溶液加入,溶液由无色恰好变成浅红色且半分钟内不褪色.
②根据上述数据,可计算出该盐酸的浓度约为0.12mol/L.
(4)在t℃时,某NaOH稀溶液中c(H+)=10-a mol•L-1,c(OH-)=10-b mol•L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw=10-12mol2•L-2.
②在该温度下,将100mL0.1mol•L-1的稀H2SO4与100mL0.4mol•L-1的NaOH溶液混合后,溶液的pH=11.
 盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.
盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.已知室温下:Ka(CH3COOH)=1.7×10-5 mol•L-1;H2CO3的电离常数Ka1=4.2×10-7mol•L-1、Ka2=5.6×10-11mol•L-1
(1)常温下,物质的量浓度相同的下列四种溶液:a、氢氧化钡溶液b、氢氧化钠溶液c、碳酸钠溶液d、碳酸氢钠溶液e、醋酸钠溶液.其PH由大到小的顺序是:a>b>c>d>e(填序号).
(2)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是b=c>a;该醋酸溶液稀释过程中,下列各量一定变小的是ad.
a.c(H+) b.c(OH-) c.$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$ d.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$
(3)以0.10mol•L-1NaOH为标准液,测定某盐酸的浓度.取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
| 实验编号 | 氢氧化钠溶液的浓度(mol•L-1) | 滴定完成时,氢氧化钠溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
| 1 | 0.10 | 24.12 | 20.00 |
| 2 | 0.10 | 23.88 | 20.00 |
| 3 | 0.10 | 24.00 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为0.12mol/L.
(4)在t℃时,某NaOH稀溶液中c(H+)=10-a mol•L-1,c(OH-)=10-b mol•L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw=10-12mol2•L-2.
②在该温度下,将100mL0.1mol•L-1的稀H2SO4与100mL0.4mol•L-1的NaOH溶液混合后,溶液的pH=11.
6.在相同条件下,下列各组中的物质按熔点由高到低排列的是( )
| A. | 干冰、冰、金属钠 | B. | 二氧化硅、食盐、硫 | ||
| C. | 金刚石、碘、氧化钙 | D. | HF、HCl、HBr |
3.燃烧法是测定有机化合物分子式的一种重要方法.完全燃烧0.1mol某烃后测得生成的CO2体积为13.44L (标准状况),生成的H2O为12.6g,该烃的同分异构体数目为( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
4.锂~碘电池可用来为心脏起搏器提供能源,其电池反应可表示为:2Li+I2→2LiI.下列有关说法错误的是( )
| A. | 放电时化学能转化为电能 | B. | 负极反应为:Li-e=Li+ | ||
| C. | 正极反应为:I2+2e-=2I- | D. | 电流由负极流向正极 |