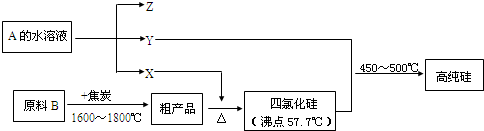
题目内容
14.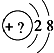 某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.
某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.①该微粒的符号为X3-,则这种微粒的结构示意图为
 ;
;②该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,该单质与水反应的化学方程式:2F2+2H2O=O2+4HF;
③该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,该单质与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑;
④该微粒的符号为X3+,其氢氧化物与强碱反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
分析 ①该微粒的符号为X3-,则质子数为10-3=7,即为N元素的微粒;
②该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,原子的质子数为10-1=9,该元素为F;
③该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,原子的质子数为10+1=11,该元素为Na;
④该微粒的符号为X3+,质子数为10+3=13,为Al元素,其氢氧化物与强碱反应生成偏铝酸钠和水.
解答 解:①该微粒的符号为X3-,则质子数为10-3=7,即为N元素的微粒,这种微粒的结构示意图为 ,故答案为:
,故答案为: ;
;
②该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,原子的质子数为10-1=9,该元素为F,该单质与水反应的化学方程式为2F2+2H2O=O2+4HF,
故答案为:2F2+2H2O=O2+4HF;
③该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,原子的质子数为10+1=11,该元素为Na,该单质与水反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;
④该微粒的符号为X3+,质子数为10+3=13,为Al元素,其氢氧化物与强碱反应生成偏铝酸钠和水,离子反应方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查微粒推断及化学反应及离子反应方程式书写,为高频考点,把握电子数与质子数的关系、元素化合物知识为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
4.下列说法正确的是(NA表示阿伏加德罗常数)( )
| A. | 在常温常压下,11.2LN2含有的分子数为0.5NA | |
| B. | 在常温常压下,1mol H2O含有的质子数为NA | |
| C. | 1.00molNaCl中,所有Na+的最外层电子总数为8NA | |
| D. | 23g钠在化学反应中失去电子数目为10 NA |
5.下列应用或事实与胶体的性质没有关系的是( )
| A. | 在河流入海口处易形成三角州 | |
| B. | 用石膏或盐卤点制豆腐 | |
| C. | 尿毒症患者做“血液透析” | |
| D. | 在饱和氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀 |
2.关于有机物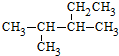 的系统命名正确的是( )
的系统命名正确的是( )
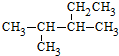 的系统命名正确的是( )
的系统命名正确的是( )| A. | 2-甲基-3-乙基丁烷 | B. | 3-甲基-2-乙基丁烷 | ||
| C. | 2,3-二甲基戊烷 | D. | 3,4-二甲基戊烷 |
19.下列叙述不正确的是( )
| A. | 不锈钢是化合物 | |
| B. | 合金的硬度一般比它的各成分金属的硬度大 | |
| C. | 黄铜是混合物 | |
| D. | 合金的熔点一般比它的各成分金属的熔点低 |
6.关于氨基酸的叙述错误的是( )
| A. | 人体内氨基酸的分解代谢最终产物是水、二氧化碳和尿素 | |
| B. | 构成蛋白质的氨基酸分子的结构通式可以表示为: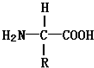 | |
| C. | 氨基酸只能和碱反应不能和酸反应 | |
| D. | 两个氨基酸通过脱水缩合形成二肽 |
3.人体内存在着酸碱平衡,如出现失衡将对人体健康产生极大危害.人体内生成的下列酸属于无机物的是( )
| A. | 乳酸(C3H6O3) | B. | 磷酸(H3PO4) | C. | 丙酮酸(C3H4O3) | D. | 乙酰乙酸(C4H6O3) |