题目内容
19.(1)在标准状况下32克气体X的体积为11.2L,则此气体的摩尔质量为多少64g/mol(2)常温下,在44g水中溶解16g CuSO4,恰好达到饱和,该溶液密度为1.2g/cm3,求:
①该溶液中阴离子的物质的量0.1mol
②该溶液中CuSO4的物质的量浓度2mol/L
③取出20.0ml该溶液,配成浓度为1.00mol/L的稀溶液,则稀释后溶液的体积是40mL
(3)已知反应14CuSO4+5FeS2+2H2O═7Cu2S+5FeSO4+12H2SO4; 若有21.6gH2O参加反应,则转移电子12.6 mol,被CuSO4氧化的FeS20.6mol.
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算气体X的物质的量,再根据M=$\frac{m}{n}$计算气体X的摩尔质量;
(2)①根据n=$\frac{m}{M}$计算CuSO4的物质的量,溶液中n(SO42-)=n(CuSO4);
②根据V=$\frac{m}{ρ}$计算溶液体积,再根据c=$\frac{n}{V}$计算溶液浓度;
③根据稀释定律计算稀释后溶液体积;
(3)FeS2参加反应时,部分S元素的化合价由-1价降低为-2价,部分S元素的化合价由-1价升高为+6价,由S元素守恒可知,被还原FeS2与被氧化FeS2的物质的量之比为7:3,反应中Cu元素化合价由+2降低为+1价,根据方程式计算参加反应FeS2、CuSO4的物质的量,计算被氧化FeS2的物质的量,根据S元素化合价比较计算转移电子物质的量,根据电子转移守恒计算被CuSO4氧化的FeS2的物质的量.
解答 解:(1)气体X的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,则气体X的摩尔质量为$\frac{32g}{0.5mol}$=64g/mol,
故答案为:64g/mol;
(2)①CuSO4的物质的量为$\frac{16g}{160g/mol}$=0.1mol,溶液中n(SO42-)=n(CuSO4)=0.1mol,
故答案为:0.1mol;
②溶液体积=$\frac{44g+16g}{1200g/L}$=0.05L,溶液浓度为$\frac{0.1mol}{0.05L}$=2mol/L,
故答案为:2mol/L;
③根据稀释定律,稀释后溶液体积为$\frac{20mL×2mol/L}{1mol/L}$=40mL,
故答案为:40mL;
(3)FeS2参加反应时,部分S元素的化合价由-1价降低为-2价,部分S元素的化合价由-1价升高为+6价,由S元素守恒可知,被还原FeS2与被氧化FeS2的物质的量之比为7:3,反应中Cu元素化合价由+2降低为+1价,
21.6g水的物质的量为$\frac{21.6g}{18g/mol}$=1.2mol,由方程式可知,参加反应FeS2为1.2mol×$\frac{5}{2}$=3mol,则被氧化FeS2的物质的量为3mol×$\frac{3}{7+3}$=0.9mol,故转移电子为0.9mol×2×[(+6)-(-1)]=12.6mol,
参加反应CuSO4的物质的量为1.2mol×$\frac{14}{2}$=8.4mol,根据电子转移守恒,被CuSO4氧化的FeS2的物质的量为$\frac{8.4mol×(2-1)}{2×[6-(-1)]}$=0.6mol,
故答案为:12.6;0.6.
点评 本题考查物质的量有关计算、物质的量浓度计算、氧化还原反应计算等,(3)中注意根据反应中元素的化合价变化分析被氧化与被还原的元素,难度中等.

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案| A. | 液氯和氯水 | B. | 酒精溶液和乙醇 | ||
| C. | 七水合硫酸亚铁和硫酸亚铁 | D. | 干冰和混有冰的干冰 |
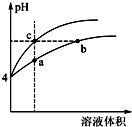 盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.
盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸.已知室温下:Ka(CH3COOH)=1.7×10-5 mol•L-1;H2CO3的电离常数Ka1=4.2×10-7mol•L-1、Ka2=5.6×10-11mol•L-1
(1)常温下,物质的量浓度相同的下列四种溶液:a、氢氧化钡溶液b、氢氧化钠溶液c、碳酸钠溶液d、碳酸氢钠溶液e、醋酸钠溶液.其PH由大到小的顺序是:a>b>c>d>e(填序号).
(2)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是b=c>a;该醋酸溶液稀释过程中,下列各量一定变小的是ad.
a.c(H+) b.c(OH-) c.$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$ d.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$
(3)以0.10mol•L-1NaOH为标准液,测定某盐酸的浓度.取20.00mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
| 实验编号 | 氢氧化钠溶液的浓度(mol•L-1) | 滴定完成时,氢氧化钠溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
| 1 | 0.10 | 24.12 | 20.00 |
| 2 | 0.10 | 23.88 | 20.00 |
| 3 | 0.10 | 24.00 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为0.12mol/L.
(4)在t℃时,某NaOH稀溶液中c(H+)=10-a mol•L-1,c(OH-)=10-b mol•L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw=10-12mol2•L-2.
②在该温度下,将100mL0.1mol•L-1的稀H2SO4与100mL0.4mol•L-1的NaOH溶液混合后,溶液的pH=11.
| 试管1:滴加3滴浓硫酸 | 试管2:滴加3滴NaOH溶液 | |
| 实验现象 | ||
| 实验结论 |
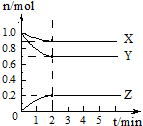 某温度时,在2L容器中X、Y、Z三种物质的物质的量随时间变化曲线如图所示,由图中数据分析,该反应的化学方程式为X+3Y?2Z,反应开始至2min,反应的平均速率v(Z)=0.05mol•L-1•min-1.
某温度时,在2L容器中X、Y、Z三种物质的物质的量随时间变化曲线如图所示,由图中数据分析,该反应的化学方程式为X+3Y?2Z,反应开始至2min,反应的平均速率v(Z)=0.05mol•L-1•min-1.
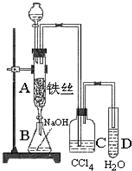 某化学课外小组用如图装置制取溴苯.
某化学课外小组用如图装置制取溴苯.