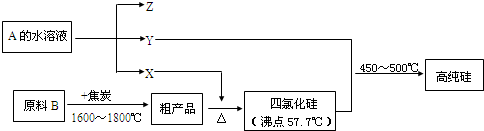
题目内容
10.某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2•2H2O).
(1)实验室采用如下图所示的装置,可将反应①粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去).
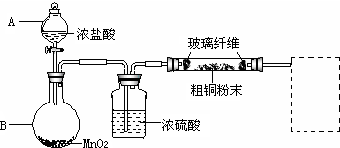
①仪器A的名称是分液漏斗.
②连接好装置后,加入药品前,应该进行的实验操作是检验装置气密性.
③装置B中发生反应的离子方程式是MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
④有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”)否.
⑤虚线内缺少实验装置,请你画出装置图,标明药品名称.
(2)试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号)cd.
a.NaOH b.NH3•H2O c.CuO d.Cu2(OH)2CO3 e.CuSO4
操作①的名称是过滤.
(3)在溶液2转化为CuCl2•2H2O的操作过程中,发现溶液颜色由蓝色变为绿色.小
组同学欲探究其原因.
已知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)+4Cl-(aq)?CuCl42-(aq)+4H2O(l)
蓝色 黄色
取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是(填序号)abc.
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失
(4)操作②需在氯化氢气流中经过加热浓缩、冷却结晶、过滤、洗涤、干燥.
分析 粗铜中含有Fe,与氯气反应生成CuCl2和FeCl3,调节溶液pH,使FeCl3发生水解生成Fe(OH)3沉淀而除去,则加入的物质应不能引入新杂质,可为Cu2(OH)2CO3、CuO、CuCO3等物质,得到的溶液2为溶液CuCl2,经蒸发浓缩,冷却结晶可得到CuCl2晶体;实验室用二氧化锰与浓盐酸发生反应生成氯化锰、氯气、水,反应离子方程式为MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,含有HCl、H2O等杂质,通过浓硫酸进行干燥后与铜反应,
(1)①仪器A是分液漏斗;
②制备气体,应首先检验装置的气密性;
③装置B中制取氯气,二氧化锰与浓盐酸发生反应生成氯化锰、氯气、水;
④HCl对反应没有影响;
⑤氯气有毒,尾气需进行处理,氯气和碱反应生成无毒物质,所以用碱液吸收尾气;
(2)由工艺流程可知,加入试剂X用于调节pH以除去杂质,主要将铁离子转化为氢氧化铁沉淀,不能引入新杂质;固体液体分离用过滤;
(3)根据平衡移动原理分析;
(4)氯化铜中的金属铜离子易水解,在氯化氢气流中可以抑制氯化铜水解,经过蒸发浓缩、冷却结晶、过滤、洗涤干燥得到CuCl2•2H2O晶体.
解答 解:(1)①仪器A是分液漏斗,向烧瓶中滴加盐酸制取氯气,
故答案为:分液漏斗;
②制备气体,不能漏气,所以连接好装置后,加入药品前,应该进行的实验操作是应首先检验装置的气密性,
故答案为:检验装置气密性;
③装置B中制取氯气,二氧化锰与浓盐酸发生反应生成氯化锰、氯气、水,反应离子方程式为MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
④HCl对反应没有影响,不需要在浓硫酸洗气瓶前增加吸收HCl的装置,
故答案为:否;
⑤反应后尾气含有氯气,不能直接排放到空气中,应用NaOH溶液进行尾气的吸收,如图 ,
,
故答案为: ;
;
(2)由工艺流程可知,加入试剂X用于调节pH以除去杂质,且不能引入新杂质.
a.NaOH引入杂质钠离子,故a错误;
b.NH3•H2O 引入铵根离子,故b错误;
c.CuO可以调节pH值,除去杂质,过量的CuO过滤除去,不引入杂质,故c正确;
d.Cu2(OH)2CO3 可以调节PH值,除去杂质,过量的Cu2(OH)2CO3过滤除去,不引入杂质,故d正确;
e.CuSO4不能调节pH值,引入硫酸根离子,故e错误;
从溶液中分离出固体,通过过滤得到的溶液2为溶液CuCl2,
故答案为:cd;过滤;
(3)a.将Y稀释,平衡向作反应移动,溶液呈蓝色,可以能够证明CuCl2溶液中转化关系,故a正确;
b.在Y中加入CuCl2晶体,溶液中Cu(H2O)42+浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系,故b正确;
c.在Y中加入NaCl固体,溶液中氯离子浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系,故c正确;
d.取Y进行电解,铜离子放电,溶液颜色最终消失,不能可以能够证明CuCl2溶液中转化关系,故d错误.
故选:abc.
(4)氯化铜为强酸弱碱盐,盐中的金属铜离子易水解,在氯化氢气流中可以抑制氯化铜水解,两水合氯化铜受热易失去结晶水,所以经过蒸发浓缩、冷却结晶、过滤、洗涤干燥得到CuCl2•2H2O晶体,
故答案为:冷却结晶.
点评 本题考查学生对工艺流程理解、实验装置的理解、平衡移动、物质分离提纯等,题目难度中等,有助于培养学生基本扎实的基础与综合运用能力,注意CuCl2•2H2O晶体需冷却结晶为易错点.

 发散思维新课堂系列答案
发散思维新课堂系列答案| A. | 不锈钢是化合物 | |
| B. | 合金的硬度一般比它的各成分金属的硬度大 | |
| C. | 黄铜是混合物 | |
| D. | 合金的熔点一般比它的各成分金属的熔点低 |
| A. | ①>②>③>④>⑤ | B. | ③>④>⑤>②>① | C. | ⑤>④>③>②>① | D. | ②>①>⑤>④>③ |
| A. | 为防止试管破裂,加热固体时试管口一般要略高于试管底 | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液 | |
| C. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| D. | 酒精灯着火时用湿抹布盖灭 |
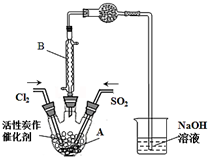 某学习小组依据反应:SO2(g)+Cl2(g?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
某学习小组依据反应:SO2(g)+Cl2(g?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.| SO2Cl2 | Cl2 | SO2 | |
| 熔点/℃ | -54.1 | -101 | -72.4 |
| 沸点/℃ | 69.1 | -34.6 | -10 |
| 性质 | 遇水发生剧烈 |
(2)B仪器的作用是使挥发的产物SO2Cl2冷凝回流.
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择a.
a.冰水浴 b.常温 c.加热至69.1℃
(4)如果通入的Cl2或SO2含有水蒸气,氯气和二氧化硫可能发生反应的化学方程式为SO2+Cl2+2H2O═H2SO4+2HCl.
(5)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应.充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收.分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W.
①经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式SO2Cl2+2H2O=H2SO4+2HCl.
②无色溶液W中的阴离子除含少量OH-外,还含有其它两种阴离子,检验溶液W中这两种阴离子方法是取少量W溶液于试管中,加入过量Ba(NO3)2溶液,有不溶于稀硝酸的白色沉淀产生,说明溶液中含有SO42-,过滤,向滤液中滴加HNO3酸化,再加入AgNO3溶液,产生白色沉淀,则说明溶液中有Cl-.
③反应完成后,在W溶液、烧杯中分别滴加过量的BaCl2溶液,均出现白色沉淀,此沉淀不溶于稀盐酸,经过滤、洗涤、干燥,称量得到的固体质量分别为xg、yg.计算SO2+Cl2?SO2Cl2反应中,SO2的转化率$\frac{X}{X+Y}$×100%(用含x、y的代数式表示).