题目内容
【题目】某兴趣小组设计将废金属合金(只含铝、铁、铜)回收再利用制备胆矾、氯化铝晶体和聚合硫酸铁[Fe2(OH)n(SO4)3n/2]m的流程如下图所示,则下列有关叙述中不正确的是( )
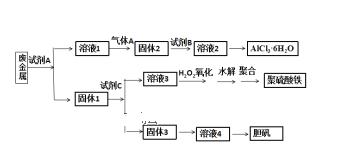
A.本实验中试剂A为氢氧化钠溶液,试剂B盐酸,试剂C为稀硫酸
B.过量气体A与溶液1的反应的离子方程式为:2AlO2- + CO2 + 3H2O = 2Al(OH) 3↓+ CO32-
C.固体3生成溶液4,可能为反应为:2Cu + O2 + 2H2SO4 = 2CuSO4 + 2H2O
D.溶液3与H2O2反应的化学方程式为:2FeSO4 + H2O2 + H2SO4 = Fe2(SO4)3 + 2H2O
【答案】B
【解析】
通过流程图,固体1中含有Fe、Cu元素,溶液1中含有Al元素,则试剂A为NaOH溶液,溶液1为偏铝酸钠,气体A为二氧化碳,固体2为氢氧化铝,试剂B为盐酸,溶液2为氯化铝溶液;试剂C为稀硫酸,固体3为铜,溶液3为硫酸亚铁,溶液4为硫酸铜。
A.通过分析可知,本实验中试剂A为氢氧化钠溶液,试剂B盐酸,试剂C为稀硫酸,与题意不符,A错误;
B.气体A与溶液1分别为二氧化碳、偏铝酸钠,过量气体CO2与NaAlO2溶液反应生成氢氧化铝沉淀和碳酸氢根离子,离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,符合题意,B正确;
C.固体3、溶液4分别为Cu、硫酸铜,可能的反应为:2Cu+O2 +2H2SO4=2CuSO4+2H2O,与题意不符,C错误;
D.硫酸亚铁与H2O2反应生成硫酸铁,化学方程式为:2FeSO4 +H2O2 + H2SO4 = Fe2(SO4)3 + 2H2O,与题意不符,D错误;
答案为B。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案【题目】第Ⅷ族元素![]() 、
、![]() 、
、![]() 性质相似,称为铁系元素,主要用于制造合金。回答下列问题:
性质相似,称为铁系元素,主要用于制造合金。回答下列问题:
(1)基态![]() 原子核外能量最高的电子位于_______能级,同周期元素中,基态原子未成对电子数与
原子核外能量最高的电子位于_______能级,同周期元素中,基态原子未成对电子数与![]() 相同的元素名称为______________。
相同的元素名称为______________。
(2)![]() 与酚类物质的显色反应常用于其离子检验,已知
与酚类物质的显色反应常用于其离子检验,已知![]() 遇邻苯二酚(
遇邻苯二酚(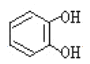 )和对苯二酚(
)和对苯二酚(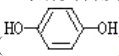 )均显绿色。邻苯二酚的熔沸点比对苯二酚_____(填“高”或“低”),原因是_________。
)均显绿色。邻苯二酚的熔沸点比对苯二酚_____(填“高”或“低”),原因是_________。
(3)有历史记载的第一个配合物是![]() (普鲁士蓝),该配合物的内界为__________。表为
(普鲁士蓝),该配合物的内界为__________。表为![]() 、
、![]() 不同配位数时对应的晶体场稳定化能(可衡量形成配合物时,总能量的降低)。由表可知,
不同配位数时对应的晶体场稳定化能(可衡量形成配合物时,总能量的降低)。由表可知,![]() 比较稳定的配离子配位数是__________(填“4”或“6”)。
比较稳定的配离子配位数是__________(填“4”或“6”)。![]() 性质活泼,易被还原,但
性质活泼,易被还原,但![]() 很稳定,可能的原因是________________。
很稳定,可能的原因是________________。
离子 | 配位数 | 晶体场稳定化能(Dq) |
| 6 | -8Dq+2p |
4 | -5.34Dq+2p | |
| 6 | -12Dq+3p |
4 | -3.56Dq+3p |
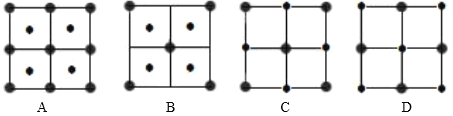
(4)![]() 晶体结构中阴阳离子的配位数均为6,则晶胞的俯视图可能是_______(填选项字母)。若晶胞参数为apm,阿伏加德罗常数的值为
晶体结构中阴阳离子的配位数均为6,则晶胞的俯视图可能是_______(填选项字母)。若晶胞参数为apm,阿伏加德罗常数的值为![]() ,晶体的密度是________
,晶体的密度是________![]() 。
。