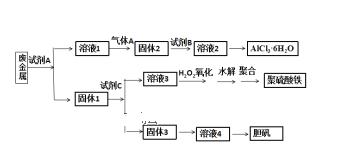
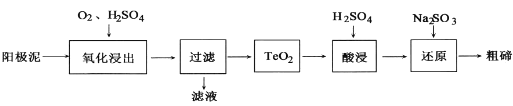
题目内容
【题目】在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g![]() 2NH3(g)ΔH<0。
2NH3(g)ΔH<0。
(1)当反应达到平衡时,N2和H2的浓度比是___;N2和H2的转化率比是____。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量___,密度___(填“变大”、“变小”或“不变”)。
(3)当达到平衡时,充入氮气,并保持体积不变,平衡将____(填“正向”、“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将_____(填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度_____(填“大于”、“小于”或“等于”)原来的2倍。
【答案】1:3 1:1 变小 不变 正向 向左移动 小于
【解析】
(1)依据起始量氮气和氢气物质的量之比等于反应之比分析判断;
(2)升温放热反应平衡逆向移动,结合ρ=![]() 以及M=
以及M=![]() 可知;
可知;
(3)增加了氮气的浓度,使平衡正向移动;
(4)根据勒夏特列原理解答。
(1)对N2(g)+3H2(g)2NH3(g) ΔH<0,在密闭容器中,开始时n(N2)∶n(H2)=2∶6=1∶3,反应时消耗n(N2)∶n(H2)=1∶3,故平衡时n(N2)∶n(H2)=1∶3,所以c(N2)∶c(H2)=1∶3,转化率之比为1∶1。
(2)该反应正反应为放热反应,升高温度,平衡向逆反应方向移动,气体的总物质的量增大,总质量不变,故平均相对分子质量变小,由ρ=![]() 知密度不变;
知密度不变;
(3)达平衡后,充入氮气,并保持体积不变,增加了氮气的浓度,使平衡正向移动;
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,根据勒夏特列原理,平衡向吸热反应的方向移动,即逆向移动,达新平衡后,容器内温度大于原来的温度,小于原来温度的2倍。

【题目】下列离子方程式的书写及评价,均合理的是
选项 | 离子方程式 | 评价 |
A | 用铜电极电解饱和KCl溶液:2H2O+2Cl- | 正确:Cl-的失电子能力比OH-强 |
B | 向CuSO4溶液中通入过量的H2S气体:Cu2++H2S=CuS↓+2H+ | 错误:H2S的酸性比H2SO4弱 |
C | Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3- +OH- ═BaCO3↓+H2O | 错误:Ba2+与HCO3-系数比应为1:2 |
D | 过量SO2通入到NaClO溶液中:SO2+ClO- +H2O= HClO+HSO3- | 正确:H2SO3的酸性比HClO强 |
A.AB.BC.CD.D
【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式(或离子方程式)的类推正确的是( )
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中: Fe + Cu2+ = Cu + Fe2+ | 将Na加入到CuSO4溶液中: 2Na + Cu2+ = Cu + 2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至溶液呈中性: 2H++SO42﹣+Ba2++2OH﹣=BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应呈中性: 2H++SO42﹣+Ba++2OH﹣=BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2: Ca2++2ClO﹣+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2: Ca2++2ClO﹣+SO2+H2O=CaSO3↓+2HClO |
A.AB.BC.CD.D
【题目】氮是化肥工业和化工生产的主要原料,工业上合成氨使用的氢气主要来自合成气(CO、H2混合气体)。请回答下列问题:
(1)工业上合成氨的反应原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH 。 已知:
2NH3(g) ΔH 。 已知:
化学键 | H-H | N≡N | N-H |
键能/kJ·mol-1 | 436 | 945.6 | 391 |
化学键的键能是形成或断裂1 mol 化学键放出或吸收的能量,单位为kJ/mol。上述反应的ΔH________________。
(2)联氨(又称肼,N2H4),试写出联氨的电子式_________;联氨又可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH1
N2H4(l)+O2(g)= N2(g)+2H2O(g) ΔH2
则N2(g)+2O2(g)=N2O4 (l) ΔH3=_________
(3)以氨气代替氢气来研发氨燃料电池是当前科研的一个热点。氨燃料电池使用的电解质溶液是KOH溶液,其装置如图所示。a电极反应式为________。若该燃料电池消耗标准状况下6.72 L空气(假设空气中O2体积分数为20%),则理论上消耗NH3的质量为_______g。

(4)甲醇燃料电池在生活应用也很广泛,在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。写出该电池的负极反应式______________。