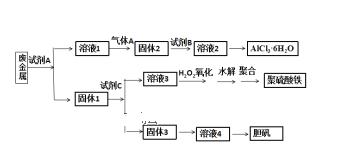
题目内容
【题目】LiFe2(PO4)3作为锂离子电池的负极材料时有良好的放电平台,通过提高材料的电导率可以有效的改善材料的性能。
(1)配平下列反应的化学方程式。___
___LiFe2(PO4)3+1Fe2O3+___CO→____CO2+___LiFePO4
(2)CO2的电子式为____,P原子的核外电子有___种不同能量的电子。
研究CO2与CH4的反应使之转化为H2和CO对减缓燃料危机,减少温室效应具有重大意义。已知CH4(g)+CO2(g)![]() 2H2(g)+2CO(g)。
2H2(g)+2CO(g)。
(3)该反应的平衡常数K=____。在2L密闭容器中,通入CO2和CH4的混合气体,30min后,CH4的质量减少了4.8g,则v(CH4)=___。
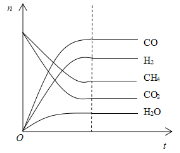
(4)根据如图可得出n(CO2)消耗___n(CH4) 消耗(填“>”、“<”和“=”),原因是___。
【答案】2LiFe2(PO4)3+1Fe2O3+3CO=3CO2+6LiFePO4 ![]() 5
5 ![]() 0.005mol/(Lmin) > 根据图中信息,有H2O生成,平衡时n(H2)<c(CO),说明一部分CO2与H2发生了反应
0.005mol/(Lmin) > 根据图中信息,有H2O生成,平衡时n(H2)<c(CO),说明一部分CO2与H2发生了反应
【解析】
(1).从化合价分析,反应中化合价变化为碳从+2价变为+4价,氧化铁的系数为1,LiFe2(PO4)3中铁的化合价为+4价,氧化铁中铁的化合价为+3价,都降低到+2价,所以氧化铁总共降低2价,LiFe2(PO4)3中铁总共降低4价,所用需要3个一氧化碳反应,再根据质量守恒定律,得方程式为: 2LiFe2(PO4)3+1Fe2O3+3CO=3CO2+6LiFePO4 ;
(2).碳的最外层有4个电子,应该形成4对共用电子,每个氧原子形成2对共用电子,所用电子式为: ![]() ;磷原子有5个能级,不同能级上的电子能量不同,所以磷有5种不同能量的电子。
;磷原子有5个能级,不同能级上的电子能量不同,所以磷有5种不同能量的电子。
(3)根据平衡常数为生成物浓度幂之积与反应物浓度幂之积的比值分析,平衡常数K= ![]() ;甲烷的物质的量为
;甲烷的物质的量为![]() ,用甲烷表示反应速率为 v(CH4)=0.3mol÷2L÷30min=0.005mol/(Lmin) ;
,用甲烷表示反应速率为 v(CH4)=0.3mol÷2L÷30min=0.005mol/(Lmin) ;
(4). 根据图中信息,有H2O生成,平衡时n(H2)<c(CO),说明一部分CO2与H2发生了反应,所以反应中二氧化碳的消耗量大于甲烷的消耗量,。

 阅读快车系列答案
阅读快车系列答案【题目】下列离子方程式的书写及评价,均合理的是
选项 | 离子方程式 | 评价 |
A | 用铜电极电解饱和KCl溶液:2H2O+2Cl- | 正确:Cl-的失电子能力比OH-强 |
B | 向CuSO4溶液中通入过量的H2S气体:Cu2++H2S=CuS↓+2H+ | 错误:H2S的酸性比H2SO4弱 |
C | Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3- +OH- ═BaCO3↓+H2O | 错误:Ba2+与HCO3-系数比应为1:2 |
D | 过量SO2通入到NaClO溶液中:SO2+ClO- +H2O= HClO+HSO3- | 正确:H2SO3的酸性比HClO强 |
A.AB.BC.CD.D