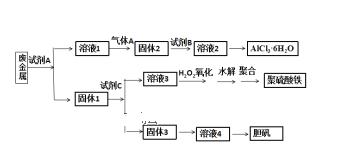
题目内容
【题目】已知反应:Cl2+2HBr=Br2+2HCl。当有0.2molHCl(g)生成时放出8.1kJ的热量。
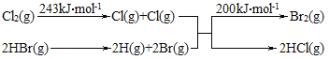
其能量变化示意图如图:请回答:
(1)该反应的热化学方程式是_____。
(2)由上述数据判断断开1molH-Cl键与断开1molH-Br键所需能量相差约为_____kJ。
【答案】Cl2(g)+2HBr(g)=Br2(g)+2HCl(g) ΔH=-81kJ·mol-1 62
【解析】
(1)热化学方程式中化学计量数表示反应物与生成物的物质的量,ΔH与化学计量数成正比。0.2mol氯化氢生成时放出8.1kJ的能量,2mol氯化氢生成时放出81kJ的能量,热化学方程式为Cl2(g)+2HBr(g)=Br2(g)+2HCl(g) ΔH=-81kJ·mol-1;
(2)化学反应的焓变:ΔH=反应物的键能总和-生成物的键能总和=243kJ·mol-1-2E(H-Br)-200kJ·mol-1-2E(H-Cl)=-81kJ·mol-1,2E(H-Br)-200kJ·mol-1-2E(H-Cl)=-124kJ·mol-1,断开1mol H-Cl键与断开1mol H-Br键所需能量相差约为62kJ。

 名校课堂系列答案
名校课堂系列答案【题目】下列离子方程式的书写及评价,均合理的是
选项 | 离子方程式 | 评价 |
A | 用铜电极电解饱和KCl溶液:2H2O+2Cl- | 正确:Cl-的失电子能力比OH-强 |
B | 向CuSO4溶液中通入过量的H2S气体:Cu2++H2S=CuS↓+2H+ | 错误:H2S的酸性比H2SO4弱 |
C | Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3- +OH- ═BaCO3↓+H2O | 错误:Ba2+与HCO3-系数比应为1:2 |
D | 过量SO2通入到NaClO溶液中:SO2+ClO- +H2O= HClO+HSO3- | 正确:H2SO3的酸性比HClO强 |
A.AB.BC.CD.D
【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式(或离子方程式)的类推正确的是( )
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中: Fe + Cu2+ = Cu + Fe2+ | 将Na加入到CuSO4溶液中: 2Na + Cu2+ = Cu + 2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至溶液呈中性: 2H++SO42﹣+Ba2++2OH﹣=BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应呈中性: 2H++SO42﹣+Ba++2OH﹣=BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2: Ca2++2ClO﹣+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2: Ca2++2ClO﹣+SO2+H2O=CaSO3↓+2HClO |
A.AB.BC.CD.D