题目内容
16.实验室可利用SbCl3的水解反应制取Sb2O3(Sb2O3的水解分三步进行,中间产物有SbOCl等)其总反应可表示为:2SbCl3+3H2O?Sb2O3+6HCl
为了得到较多、较纯的Sb2O3,操作时要将SbCl3徐徐加入大量水中,反应后期还要加入少量氨水,试利用平衡移动原理说明这两项操作的作用.
分析 根据平衡移动原理解答,改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动.
解答 解:SbCl3加水的总反应方程式为:2SbCl3+3H2O=Sb2O3+6HCl (总的),而分步骤为:第二步:SbCl3+H2O?SbOCl↓+2HCl;2SbOCl+2H2O?Sd2O3•H2O+2HCl,前期HCl的H+浓度越高,水解难,反应越难进行,加多点水PH越接近7,H+对水的水解抑制作用越弱,有利于水解反应的进行;而后期Sb3+离子浓度很低,靠单纯的水的水解很难再反应下去,已经达到水解平衡,所以要加NH3•H2O促进水解,SbCl3 +2NH3•H2O=SbOCl↓+2NH4Cl+H2O,
答:前期多点水PH越接近7,H+对水的水解抑制作用越弱,有利于水解反应的进行;而后期Sb3+离子浓度很低,靠单纯的水的水解很难再反应下去,已经达到水解平衡,所以要加NH3•H2O促进水解,SbCl3 +2NH3•H2O=SbOCl↓+2NH4Cl+H2O.
点评 考查影响化学平衡移动的因素,比较基础,注意对化学平衡移动原理的理解,移动结果是减弱改变趋势,比较容易.

练习册系列答案
相关题目
8.下列如图装置应用于实验室制取NH3气体,并用AlCl3溶液吸收多余氨气制氢氧化铝,最后回收氯化铵的实验,能达到实验目的是( )
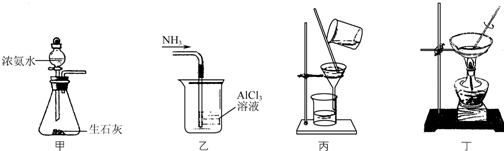

| A. | 用装置甲制取NH3 | |
| B. | 用装置乙吸收NH3制取Al(OH)3 | |
| C. | 用装置丙在不断搅拌下分离Al(OH)3和NH4Cl溶液 | |
| D. | 用装置丁蒸干NH4Cl溶液并灼烧制NH4Cl |
3.2002年诺贝尔化学奖表彰了两项成果,其中一项是瑞士科学家库尔特•维特里希发明的“利用核磁共振技术测定溶液中生物大分子三维结构的方法”.在化学上经常使用的是核磁共振氢谱,它是根据不同化学环境的氢原子在核磁共振氢谱中给出的信号不同来确定有机物分子中的不同的氢原子.下列有机物分子在核磁共振氢谱中只给出2种信号,且强度(个数比)是1:3的是( )
| A. | 1,2,3三甲基苯 | B. | 丁烷 | C. | 异丙醇 | D. | 醋酸叔丁酯 |
3. 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A. | 原混合液中NO3-的物质的量为0.4 mol | |
| B. | OA段产生是NO,AB段反应为2Fe3++Fe=3Fe2+,BC段产生氢气 | |
| C. | 溶液中最终溶质为FeSO4 | |
| D. | c(H2SO4)为5 mol•L-1 |
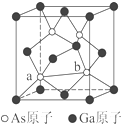 元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等.这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用.
元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等.这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用.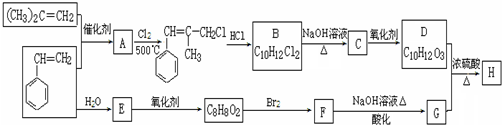
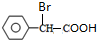 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$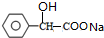 +NaBr+H2O.
+NaBr+H2O.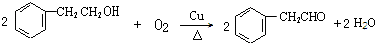 .
.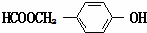 (写结构简式).
(写结构简式).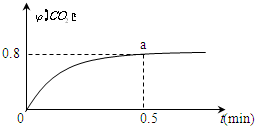 常温下I2O5(s)可用于检测CO,反应原理为:5CO(g)+I2O5(s)?5CO2(g)+I2(s)△H<0.一定温度下,向2L恒容密闭容器中加入足量I2O5(s),并通入1molCO.反应中CO2的体积分数φ(CO2)随时间的变化如图所示:
常温下I2O5(s)可用于检测CO,反应原理为:5CO(g)+I2O5(s)?5CO2(g)+I2(s)△H<0.一定温度下,向2L恒容密闭容器中加入足量I2O5(s),并通入1molCO.反应中CO2的体积分数φ(CO2)随时间的变化如图所示: