题目内容
8.下列如图装置应用于实验室制取NH3气体,并用AlCl3溶液吸收多余氨气制氢氧化铝,最后回收氯化铵的实验,能达到实验目的是( )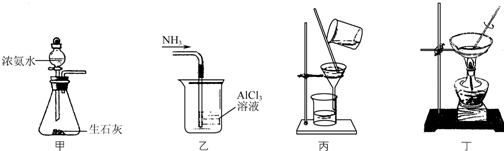
| A. | 用装置甲制取NH3 | |
| B. | 用装置乙吸收NH3制取Al(OH)3 | |
| C. | 用装置丙在不断搅拌下分离Al(OH)3和NH4Cl溶液 | |
| D. | 用装置丁蒸干NH4Cl溶液并灼烧制NH4Cl |
分析 A.CaO与水反应增大氢氧根离子浓度,且放热,均可使氨气逸出;
B.氨气极易溶于水;
C.过滤时不能搅拌,易捣破滤纸;
D.加热NH4Cl分解生成氨气和HCl.
解答 解:A.CaO与水反应增大氢氧根离子浓度,且放热,均可使氨气逸出,则图中固液反应装置可制备氨气,故A正确;
B.氨气极易溶于水,导管在液面下,图中装置可发生倒吸,故B错误;
C.过滤时不能搅拌,易捣破滤纸,则不能分离Al(OH)3和NH4Cl溶液,故C错误;
D.蒸干NH4Cl溶液,氯化铵分解,应选结晶法制NH4Cl,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及气体的制备、收集及混合物分离提纯等,把握反应原理、实验装置的作用为解答的关键,侧重分析与实验能力的考查,题目难度不大,选项D为易错点.

练习册系列答案
相关题目
19.下列除杂质的方法可行的是( )
| A. | 除去NaHCO3溶液中少量的Na2CO3:加入适量稀盐酸 | |
| B. | 除去FeCl2溶液中少量的FeCl3:加入稍过量铁粉,过滤 | |
| C. | 除去NH4Cl固体中少量I2:加热,I2升华除去 | |
| D. | 除去乙烯中的少量SO2:通过酸性KMnO4溶液,洗液 |
13.已知:S(g)+O2(g)═SO2(g);△H1
S(s)+O2(g)═SO2(g);△H2
2H2S(g)+O2(g)═2S(s)+2H2O(l);△H3
2H2S(g)+3O2(g)═2SO2(g)+2H2O(l);△H4
SO2(g)+2H2S(g)═3S(s)+2H2O(l);△H5
下列关于上述反应焓变的判断不正确的是( )
S(s)+O2(g)═SO2(g);△H2
2H2S(g)+O2(g)═2S(s)+2H2O(l);△H3
2H2S(g)+3O2(g)═2SO2(g)+2H2O(l);△H4
SO2(g)+2H2S(g)═3S(s)+2H2O(l);△H5
下列关于上述反应焓变的判断不正确的是( )
| A. | △H1<△H2 | B. | △H3<△H4 | C. | △H5=△H3-△H2 | D. | 2△H5=3△H3-△H4 |

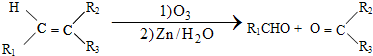
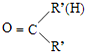 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$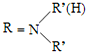 +H2O
+H2O +HNO3$→_{△}^{浓硫酸}$
+HNO3$→_{△}^{浓硫酸}$ +H2O
+H2O
 .(写出其中的一种的结构简式).
.(写出其中的一种的结构简式). $\stackrel{反应条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件下}^{C}$J$\stackrel{还原}{→}$
$\stackrel{反应条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件下}^{C}$J$\stackrel{还原}{→}$
 .
.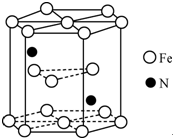 铁及其化合物在生产生活及科学研究方面应用非常广泛.
铁及其化合物在生产生活及科学研究方面应用非常广泛. .
. .
.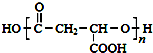 ,合成M的流程图如下:
,合成M的流程图如下: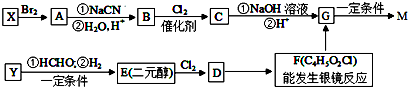
 ,
, .
.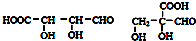 .
.