题目内容
1.2014诺贝尔物理学奖授予开发蓝色发光二极管(LED)的三位科学家.长期以来,人们发明了红色及绿色LED,但三原色之一的蓝色LED却因在材料环节遇阻而被断言“难以在20世纪实现”.通过科学家漫长的实验,发现氮化镓晶体可以产生蓝色LED.资料显示:①在室温下,氮化镓不溶于水、酸和碱.但在加热时氮化镓可溶于NaOH、H2SO4.
②氮化镓晶体的制备通常有两种方法:
a、通常以甲基镓Ga(CH3)3作为镓源,NH3作为氮源,在一定条件下反应制取氮化镓
b、通过甲基镓Ga(CH3)3分解产生单质镓,利用分解出的Ga与NH3的化学反应实现的,其的反应方程式为:
2Ga(s)+2NH3(g)?2GaN(s)+3H2(g)
③氢氧化镓Ga(OH)3与氢氧化铝类似,均有两性.
(1)下列有关镓及其化合物说法正确的是B.
A、第ⅢA族元素铟的性质与镓相似,氮化铟的化学式为In2N3
B、甲基镓与氨气反应时除生成氮化镓外,还生成CH4
C、元素周期表中镓的金属性比铝弱
D、镓位于元素周期表第四周期第ⅡA族
(2)三甲基镓在常温常压下为无色透明有毒液体.在空气中易氧化,在室温自燃,燃烧时产生金属氧化物白烟,其他元素均转化为稳定的氧化物.请写出三甲基镓在空气中自燃的化学方程式:2Ga(CH3)3+12O2=Ga2O3+6CO2+9H2O.
(3)工业上利用Ga与NH3合成氮化镓的反应方程式为:
2Ga(s)+2NH3(g)?2GaN(s)+3H2(g)△H<0
①请写出上述反应的化学平衡常数表达式:$\frac{{c}^{3}({H}_{2})}{{c}^{2}(N{H}_{3})}$.
②在恒温恒容的密闭体系内进行上述可逆反应,下列有关表达正确的是A

A、①图象中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温或加压
B、②图象中纵坐标可以为镓的转化率
C、③图象中纵坐标可以为化学反应速率
D、④图象中纵坐标可以为体系内混合气体平均相对分子质量
(4)工业上提纯镓的方法很多,其中以电解精炼法为多.具体原理如下:以待提纯的粗镓(内含Zn、Fe、Cu杂质)为阳极,以高纯镓为阴极,以NaOH水溶液为电解质溶液.在电流作用下使粗镓在阳极溶解进入电解质溶液,通过某种特殊的离子迁移技术到达阴极并在阴极放电析出高纯镓.电解时阳极反应方程式为:Ga-3e-+4OH-=GaO2-+2H2O
①请写出在阳极生成的GaO2-通过离子迁移到阴极时,阴极电极反应方程式
GaO2-+3e-+2H2O=Ga+4OH-.
②已知离子氧化性顺序为:Zn2+<Ga3+<Fe2+<Cu2+,请写出电解精炼镓时阳极泥的成分Fe、Cu.(填化学式)
分析 (1)A、第ⅢA族元素铟的性质与镓相似,氮化铟的化学式为InN;
B、甲基镓与氨气反应时除生成氮化镓外,根据元素守恒知,还生成CH4;
C、同一主族元素,元素的金属性随着原子序数增大而增强;
D、镓位于元素周期表第四周期第IIIA族;
(2)该金属氧化物Ga2O3,C元素的稳定氧化物是二氧化碳、H元素的稳定氧化物是水,根据反应物、生成物书写方程式;
(3)①化学平衡常数K=$\frac{{c}^{3}({H}_{2})}{{c}^{2}(N{H}_{3})}$;
②A、①图象中如果纵坐标为正反应速率,升高温度或增大压强,反应速率增大;
B、Ga是固体,没有浓度可言,不能计算其转化率;
C、Ga是固体,其质量不影响反应速率;
D、相同压强下,升高温度,平衡逆向移动,平均相对分子质量增大;相同温度下,增大压强,平衡逆向移动,平均相对分子质量增大;
(4)①阴极上GaO2-得电子发生还原反应生成Ga;
②离子氧化性顺序为:Zn2+<Ga3+<Fe2+<Cu2+,则金属还原性顺序为Zn>Ge>Fe>Cu,则阳极上Zn、Ge失电子进入电解质溶液,Fe、Cu以金属单质进入电解质溶液.
解答 解:(1)A、第ⅢA族元素铟的性质与镓相似,氮化铟的化学式为InN,故A错误;
B、甲基镓与氨气反应时除生成氮化镓外,根据元素守恒知,还生成CH4,故B正确;
C、同一主族元素,元素的金属性随着原子序数增大而增强,所以Ga的金属性大于Al,故C错误;
D、镓位于元素周期表第四周期第IIIA族,故D错误;
故选B;
(2)该金属氧化物Ga2O3,C元素的稳定氧化物是二氧化碳、H元素的稳定氧化物是水,根据反应物、生成物书写方程式为2Ga(CH3)3+12O2=Ga2O3+6CO2+9H2O,
故答案为:2Ga(CH3)3+12O2=Ga2O3+6CO2+9H2O;
(3)①化学平衡常数K=$\frac{{c}^{3}({H}_{2})}{{c}^{2}(N{H}_{3})}$,故答案为:$\frac{{c}^{3}({H}_{2})}{{c}^{2}(N{H}_{3})}$;
②A、①图象中如果纵坐标为正反应速率,升高温度或增大压强,反应速率增大,图象符合题意,故正确;
B、Ga是固体,没有浓度可言,不能计算其转化率,故错误;
C、Ga是固体,其质量不影响反应速率,故错误;
D、相同压强下,升高温度,平衡逆向移动,平均相对分子质量增大;相同温度下,增大压强,平衡逆向移动,平均相对分子质量增大,所以温度高的曲线在上面,故错误;
故选A;
(4)阴极上GaO2-得电子发生还原反应生成Ga,电极反应式为GaO2-+3e-+2H2O=Ga+4OH-,故答案为:GaO2-+3e-+2H2O=Ga+4OH-;
②离子氧化性顺序为:Zn2+<Ga3+<Fe2+<Cu2+,则金属还原性顺序为Zn>Ge>Fe>Cu,则阳极上Zn、Ge失电子进入电解质溶液,Fe、Cu以金属单质进入电解质溶液,则阳极泥成分是Fe、Cu,故答案为:Fe、Cu.
点评 本题考查同一主族原子结构和性质,涉及电解原理、化学平衡移动影响因素、化学平衡常数等知识点,综合性较强,侧重考查基本理论,明确电解原理、化学平衡移动原理等知识点即可解答,难点是(3)题图象分析,题目难度中等.

 名校课堂系列答案
名校课堂系列答案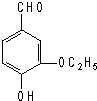
| A. | 1 mol乙基香草醛最多可与1 mol氢气发生加成反应 | |
| B. | 乙基香草醛可与Br2的CCl4溶液发生加成反应 | |
| C. | 1mol乙基香草醛可与含3 mol NaOH的水溶液完全反应 | |
| D. | 乙基香草醛能被酸性高锰酸钾、银氨溶液、新制的氢氧化铜等氧化 |
| A. | 使甲基橙变红色的溶液中:K+、Na+、SO42-、CO32- | |
| B. | pH=14的溶液中:K+、Na+、Cl-、AlO2- | |
| C. | 0.1 mol•L-1NH4I溶液中:Na+、Fe3+、Cl-、SO42- | |
| D. | 与铝反应产生大量氢气的溶液中:Na+、NH4+、HCO3-、NO3- |
S(s)+O2(g)═SO2(g);△H2
2H2S(g)+O2(g)═2S(s)+2H2O(l);△H3
2H2S(g)+3O2(g)═2SO2(g)+2H2O(l);△H4
SO2(g)+2H2S(g)═3S(s)+2H2O(l);△H5
下列关于上述反应焓变的判断不正确的是( )
| A. | △H1<△H2 | B. | △H3<△H4 | C. | △H5=△H3-△H2 | D. | 2△H5=3△H3-△H4 |
| A. | 糖类物质的分子都可以用Cm(H2O)n来表示 | |
| B. | 凡能溶于水具有甜味的物质都属于糖类 | |
| C. | 糖类都能发生水解反应 | |
| D. | 糖类是多羟基醛或多羟基酮以及水解能生成它们的化合物 |

 I、离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝.
I、离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝.