题目内容
4.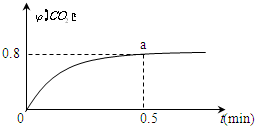 常温下I2O5(s)可用于检测CO,反应原理为:5CO(g)+I2O5(s)?5CO2(g)+I2(s)△H<0.一定温度下,向2L恒容密闭容器中加入足量I2O5(s),并通入1molCO.反应中CO2的体积分数φ(CO2)随时间的变化如图所示:
常温下I2O5(s)可用于检测CO,反应原理为:5CO(g)+I2O5(s)?5CO2(g)+I2(s)△H<0.一定温度下,向2L恒容密闭容器中加入足量I2O5(s),并通入1molCO.反应中CO2的体积分数φ(CO2)随时间的变化如图所示:(1)该反应的平衡常数表达式K=$\frac{[C{O}_{2}]^{5}}{[CO]^{5}}$.
(2)0~0.5min内的平均反应速率ν(CO)=0.8mol/(mol•L).
(3)反应达平衡后,为使容器中CO2的体积分数φ(CO2)增大
的措施是:降低温度(答1种即可).
(4)保持温度和体积不变,若开始加入CO(g)的物质的量是原来的2倍,则下列说法正确的是AC.
A.平衡时生成I2的质量为原来的2倍
B.达到平衡的时间为原来的2倍
C.平衡时混合气体的物质的量为原来的2倍
D.平衡时混合气体的平均摩尔质量和密度不变.
分析 (1)化学平衡常数K=$\frac{生成物浓度系数的幂次方}{生成物浓度系数的幂次方}$,固体和纯液体不列入;
(2)列三段式求出0~0.5min内反应消耗的CO,再求出其反应速率;
(3)欲增大容器中CO2的体积分数φ(CO2),则平衡正移,根据影响平衡的因素分析;
(4)该反应反应前后气体的物质的量相同,保持温度和体积不变,若开始加入CO(g)的物质的量是原来的2倍,则达到平衡时与原平衡是等效平衡,根据等效平衡的特点分析.
解答 解:(1)化学平衡常数K=$\frac{生成物浓度系数的幂次方}{生成物浓度系数的幂次方}$=$\frac{[C{O}_{2}]^{5}}{[CO]^{5}}$,故答案为:$\frac{[C{O}_{2}]^{5}}{[CO]^{5}}$;
(2)设0~0.5min内反应消耗的CO为xmol,
5CO(g)+I2O5(g)?5CO2(g)+I2(s)
起始量(mol):1 0
反应量(mol):x x
平衡量(mol):1-x x
则 $\frac{xmol}{1mol}$=0.8,所以x=0.8,则v(CO)=$\frac{\frac{n}{V}}{t}$=$\frac{\frac{0.8mol}{2L}}{5min}$=0.8mol/(mol•L);
故答案为:0.8mol/(mol•L);
(3)欲增大容器中CO2的体积分数φ(CO2),则平衡正移,已知该反应正方向为放热反应,所以降低温度平衡正移;
故答案为:降低温度;
(4)该反应反应前后气体的物质的量相同,保持温度和体积不变,若开始加入CO(g)的物质的量是原来的2倍,则达到平衡时与原平衡是等效平衡,
A.等效平衡的转化率相同,若开始加入CO(g)的物质的量是原来的2倍,则生成I2的质量为原来的2倍,故A正确;
B.反应物的浓度增大,反应速率加快,所以达到平衡的时间比原来的2倍小,故B错误;
C.该反应反应前后气体的物质的量相同,保持温度和体积不变,若开始加入CO(g)的物质的量是原来的2倍,则达到平衡时与原平衡是等效平衡,平衡时混合气体的物质的量为原来的2倍,故C正确;
D.该反应反应前后气体的物质的量相同,当开始加入CO(g)的物质的量是原来的2倍,达到平衡时,气体的物质的量增大2倍,质量也增大2倍,所以混合气体的平均摩尔质量不变,混合气体的体积不变,气体的质量增大,所以气体的密度增大,故D错误;
故答案为:AC.
点评 本题考查了化学平衡的有关计算、影响平衡的因素、平衡状态的判断,题目难度较大,侧重于考查学生对知识的综合应用能力.

 名校课堂系列答案
名校课堂系列答案| A. | 对于Si+O2═SiO2,每当新形成2NA个Si-O键,需要断开NA个Si-Si键 | |
| B. | 12.0g熔融的NaHSO4中含有的阳离子数为0.1NA | |
| C. | 次氯酸光照分解产生22.4mL气体(标准状况)转移的电子数为0.002NA | |
| D. | 电解精炼铜时,若阴极析出32g铜,则转移的电子数为NA |
| A. | 除去NaHCO3溶液中少量的Na2CO3:加入适量稀盐酸 | |
| B. | 除去FeCl2溶液中少量的FeCl3:加入稍过量铁粉,过滤 | |
| C. | 除去NH4Cl固体中少量I2:加热,I2升华除去 | |
| D. | 除去乙烯中的少量SO2:通过酸性KMnO4溶液,洗液 |
S(s)+O2(g)═SO2(g);△H2
2H2S(g)+O2(g)═2S(s)+2H2O(l);△H3
2H2S(g)+3O2(g)═2SO2(g)+2H2O(l);△H4
SO2(g)+2H2S(g)═3S(s)+2H2O(l);△H5
下列关于上述反应焓变的判断不正确的是( )
| A. | △H1<△H2 | B. | △H3<△H4 | C. | △H5=△H3-△H2 | D. | 2△H5=3△H3-△H4 |

 I、离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝.
I、离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝.
 .
. .
. .
.
 .
.