题目内容
6. 元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等.这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用.
元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等.这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用.请回答下列问题:
(1)N4分子是一种不稳定的多氮分子,这种物质分解后能产生无毒的氮气并释放出大量能量,能被应用于制造推进剂或炸药.N4是由四个氮原子组成的氮单质,其中氮原子采用的轨道杂化方式为sp3,该分子的空间构型为正四面体,N-N键的键角为60°.
(2)基态砷原子的最外层电子排布式为4s24p3.
(3)N、P、As原子的第一电离能由大到小的顺序为N>P>As(用元素符号表示).
(4)叠氮化钠(NaN3)用于汽车安全气囊中氮气的发生剂,写出与N3-互为等电子体的分子的化学式CO2或CS2或N2O(任写一种即可).
(5)天然氨基酸的命名常用俗名(根据来源与性质),例如,最初从蚕丝中得到的氨基酸叫丝氨酸[HOCH2CH(NH2)COOH].判断丝氨酸是否存在手性异构体?是(填“是”或“否”)
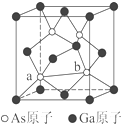
(6)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少.已知立方砷化镓晶胞的结构如图所示,其晶胞边长为c pm,则密度为$\frac{5.8×1{0}^{32}}{{N}_{A}•{c}^{3}}$g•cm-3(用含c的式子表示,设NA为阿伏加德罗常数的值),a位置As原子与b位置As原子之间的距离为$\frac{\sqrt{2}}{2}$cpm(用含c的式子表示).
分析 (1)N4中氮原子的轨道杂化方式为sp3,其空间构型与P4(白磷)相似;
(2)砷位于第四周期ⅤA族,其最外层电子排布式为4s24p3;
(3)同主族元素从上到下,元素的电负性逐渐减小;
(4)原子数相同,价电子数相同的微粒互为等电子体;
(5)有机物分子中C原子连接4个不同的原子或原子团,则该分子存在手性异构体;
(6)计算出晶胞中微粒数,利用ρ=$\frac{m}{V}$计算;a位置As原子与b位置As原子之间的距离为晶胞立方体体对角线的一半.
解答 解:(1)N4中氮原子的轨道杂化方式为sp3,其空间构型与P4(白磷)相似,空间构型应为正四面体结构,N-N键的键角为60°;
故答案为:正四面体;60°;
(2)砷为33号元素,位于第四周期ⅤA族,其最外层电子排布式为4s24p3;
故答案为:4s24p3;
(3)同主族元素从上到下,元素的电负性逐渐减小,则电负性:N>P>As;
故答案为:N>P>As;
(4)原子数相同,价电子数相同的微粒互为等电子体,则与N3-互为等电子体的微粒有CO2或CS2或N2O等;
故答案为:CO2或CS2或N2O;
(5)有机物分子中C原子连接4个不同的原子或原子团,则该分子存在手性异构体,HOCH2CH(NH2)COOH分子中第二个碳原子属于手性碳原子,则该分子存在手性异构体;
故答案为:是;
(6)晶胞中Ga原子数为6×$\frac{1}{2}$+8×$\frac{1}{8}$=4,As原子数为4,则ρ=$\frac{m}{V}$=$\frac{\frac{75×4+70×4}{{N}_{A}}}{(c×1{0}^{-10})^{3}}$=$\frac{5.8×1{0}^{32}}{{N}_{A}•{c}^{3}}$g•cm-3;a位置As原子与b位置As原子之间的距离为晶胞立方体体对角线的一半,则两原子之间的距离为$\frac{1}{2}$$\sqrt{{c}^{2}+{c}^{2}}$=$\frac{\sqrt{2}}{2}$cpm;
故答案为:$\frac{5.8×1{0}^{32}}{{N}_{A}•{c}^{3}}$;$\frac{\sqrt{2}}{2}$c.
点评 本题考查学生对物质结构与性质模块的掌握情况,涉及电负性、电子排布、空间结构、等电子体、晶胞的有关计算等,考查知识全面、覆盖广,难度适中,可以衡量学生对该模块主干知识的掌握情况.

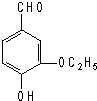
| A. | 1 mol乙基香草醛最多可与1 mol氢气发生加成反应 | |
| B. | 乙基香草醛可与Br2的CCl4溶液发生加成反应 | |
| C. | 1mol乙基香草醛可与含3 mol NaOH的水溶液完全反应 | |
| D. | 乙基香草醛能被酸性高锰酸钾、银氨溶液、新制的氢氧化铜等氧化 |
| A. | 对于Si+O2═SiO2,每当新形成2NA个Si-O键,需要断开NA个Si-Si键 | |
| B. | 12.0g熔融的NaHSO4中含有的阳离子数为0.1NA | |
| C. | 次氯酸光照分解产生22.4mL气体(标准状况)转移的电子数为0.002NA | |
| D. | 电解精炼铜时,若阴极析出32g铜,则转移的电子数为NA |
 X(g)+Y(?)ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是
X(g)+Y(?)ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是
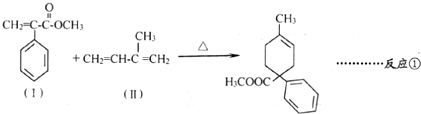
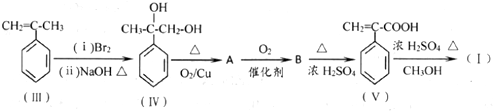
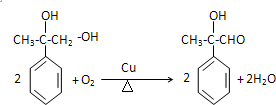 .
. 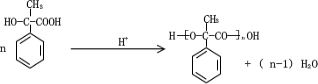 .
.  .
. 和其他无机物叫合成
和其他无机物叫合成 ,最合理的方案
,最合理的方案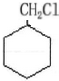 $→_{△}^{NaOH、醇}$
$→_{△}^{NaOH、醇}$ $\stackrel{Cl_{2}}{→}$
$\stackrel{Cl_{2}}{→}$