题目内容
3. 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A. | 原混合液中NO3-的物质的量为0.4 mol | |
| B. | OA段产生是NO,AB段反应为2Fe3++Fe=3Fe2+,BC段产生氢气 | |
| C. | 溶液中最终溶质为FeSO4 | |
| D. | c(H2SO4)为5 mol•L-1 |
分析 由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑.
A.OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,根据铁的物质的量结合离子方程式计算;
B.铁先与硝酸反应生成一氧化氮与铁离子,之后铁与铁离子反应生产亚铁离子,最后是铁和硫酸反应;
C.铁先与硝酸反应,之后铁与铁离子反应生产亚铁离子,最后是铁和硫酸反应,铁单质全部转化为亚铁离子,硝酸全部起氧化剂作用,没有显酸性的硝酸;
D.根据铁和硫酸的反应中铁的质量来确定所需硫酸的量,进而确定硫酸的浓度.
解答 解:A.OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,所以n(NO3-)=2n(Fe)=2×$\frac{11.2g}{56g/mol}$=0.4mol,故A正确;
B.由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,故B正确;
C.硝酸全部被还原,没有显酸性的硝酸,因为溶液中有硫酸根,并且铁单质全部转化为亚铁离子,所以溶液中最终溶质为FeSO4,故C正确;
D.反应消耗22.4g铁,也就是$\frac{22.4g}{56g/mol}$=0.4mol,所有的铁都在硫酸亚铁中,根据硫酸根守恒,所以每份含硫酸0.4mol,所以硫酸的浓度为:$\frac{0.4mol}{0.1L}$=4mol/l,故D错误;
故选D.
点评 本题以图象为载体,考查有关金属和酸反应的计算题,题目难度较大,关键根据图象分析各段发生的反应,注意与铁的反应中硝酸全部起氧化剂作用,试题侧重考查学生的分析、理解能力及化学计算能力.

 金钥匙试卷系列答案
金钥匙试卷系列答案| A. | n(NO2-)+n(OH-)-n(H+)=0.1 mol | |
| B. | 若加入少量CH3COONa固体,溶液的碱性会减弱 | |
| C. | 若再通入0.01 mol HCl气体,溶液pH大于2(忽略溶液体积的变化) | |
| D. | 此时溶液的pH大于0.1 mol•L-1的CH3COONa溶液 |
| A. | 8种 | B. | 14种 | C. | 16种 | D. | 18种 |
| A. | 煤和石油都是混合物,均由碳和氢两种元素组成 | |
| B. | 液化石油气和天然气的主要成分都是甲烷 | |
| C. | 煤的干馏和石油的分馏发生的都是化学变化 | |
| D. | 用溴的四氯化碳溶液可鉴别分馏获得的汽油和裂化获得的汽油 |
 .
.
 .
. .
. .
.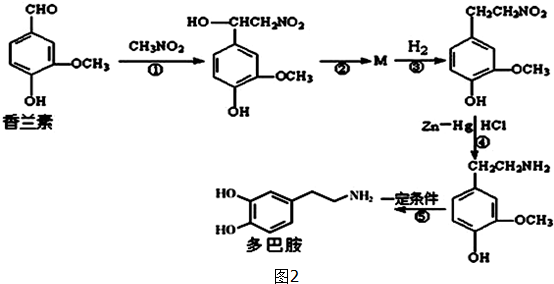
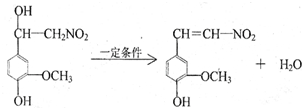 .
.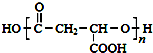 ,合成M的流程图如下:
,合成M的流程图如下: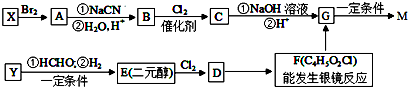
 ,
, .
.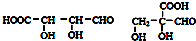 .
. B.(CH3)3CCH2CH3 C.
B.(CH3)3CCH2CH3 C. D.正己烷.
D.正己烷.