题目内容
4.下列对HClO分子结构的描述,正确的是( )| A. | O原子发生sp杂化 | B. | O原子与H、Cl都形成σ键 | ||
| C. | 该分子为直线型分子 | D. | HClO分子的结构式是:H-Cl-O |
分析 A、通过价层电子对互斥理论计算中心原子的价层电子对数,判断杂化类型;
B、共价单键为σ键;
C、HClO中O的价层电子对数为4,孤电子对数为2,空间构型为V型;
D、HClO分子的结构式是:H-O-Cl.
解答 解:A、HClO中O原子形成2个σ键,孤电子对个数=$\frac{1}{2}$×(6-2×1)=2,价层电子对数为4,为sp3杂化,故A错误;
B、从次氯酸的结构式可以看出含有O-H、O-Cl,共价单键为σ键,故B正确;
C、HClO中O价层电子对数为4,孤电子对数为2,空间构型为V型,故C错误;
D、HClO分子的结构式是:H-O-Cl,故D错误,故选B.
点评 本题主要考查了次氯酸分子的结构,明确中心原子杂化类型的判断是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
14.下列实验不能成功的是( )
| A. | 将电石和水反应后的气体通入溴水中,如果溴水褪色,证明乙炔和溴发生了反应 | |
| B. | 实验室制溴苯时,将苯与液溴混合后加到有铁丝的反应容器中 | |
| C. | 往酸性KMnO4溶液中通入乙烯来证明乙烯有还原性 | |
| D. | 乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |
15.化学与人类生活、环境保护及社会可持续发展密切相关,下列有关叙述正确的是( )
| A. | 大量开发利用深海可燃冰,有助于海洋生态环境的治理 | |
| B. | 汽车尾气中含有大量大气污染物,其原因是汽油不完全燃烧造成的 | |
| C. | 煤炭燃烧过程安装固硫装置,目的是提高煤的利用率 | |
| D. | PM2.5表面积大,能吸附大量的有毒有害物质,对人的肺功能造成很大危害 |
12.某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹).
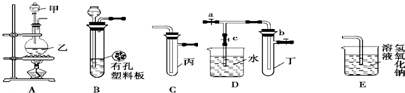
请按要求填空:
(1)利用B装置可制取的气体有H2、CO2(填2种).
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验.若在丙中加入适量水,即可制得氯水.将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象结论如下:
请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由.实验Ⅰ结论不合理,因为Cl2也有氧化性,此实验无法确定是Cl2还是HClO漂白;实验Ⅱ结论不合理,因为制取的氯气中含有HCl气体,HCl溶于水后能与NaHCO3粉末反应产生气泡
(3)请利用上述A、C装置设计一个简单的实验,验证Cl2和Br2的氧化性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论)在甲、乙、丙中分别装入浓盐酸、MnO2、NaBr溶液,烧瓶中有黄绿色气体生成,试管中溶液由无色变为橙色,证明Cl2的氧化性强于Br2.
(4)B、D、E装置相连后,在B中盛装足量浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验.B中发生反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹a、b,再打开止水夹c,使烧杯中的水进入试管丁的操作是双手紧握(或微热)试管丁使试管中气体逸出,NO2与水接触后即可引发烧杯中的水倒流入试管丁.试管丁中的NO2与一定量的O2混合后倒插水中,试管$\frac{9}{10}$充满水,则原试管丁中的混合气体的平均分子量可能为42.08或44.04.(保留二位小数)

请按要求填空:
(1)利用B装置可制取的气体有H2、CO2(填2种).
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验.若在丙中加入适量水,即可制得氯水.将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象结论如下:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入 NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
(3)请利用上述A、C装置设计一个简单的实验,验证Cl2和Br2的氧化性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论)在甲、乙、丙中分别装入浓盐酸、MnO2、NaBr溶液,烧瓶中有黄绿色气体生成,试管中溶液由无色变为橙色,证明Cl2的氧化性强于Br2.
(4)B、D、E装置相连后,在B中盛装足量浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验.B中发生反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹a、b,再打开止水夹c,使烧杯中的水进入试管丁的操作是双手紧握(或微热)试管丁使试管中气体逸出,NO2与水接触后即可引发烧杯中的水倒流入试管丁.试管丁中的NO2与一定量的O2混合后倒插水中,试管$\frac{9}{10}$充满水,则原试管丁中的混合气体的平均分子量可能为42.08或44.04.(保留二位小数)
19.实验测得BeCl2为共价化合物,两个Be-Cl键间的夹角应为( )
| A. | 60° | B. | 90° | C. | 120° | D. | 180° |
9. 在常温下A、B、C、D、E是5种常见的气体,F是固体,它们之间存在如下的转化关系,转化关系中涉及的三步反应均是化合反应.已知D分子是含有18个电子的异核双原子分子,E是4核10电子分子.下列说法中不正确的是( )
在常温下A、B、C、D、E是5种常见的气体,F是固体,它们之间存在如下的转化关系,转化关系中涉及的三步反应均是化合反应.已知D分子是含有18个电子的异核双原子分子,E是4核10电子分子.下列说法中不正确的是( )
 在常温下A、B、C、D、E是5种常见的气体,F是固体,它们之间存在如下的转化关系,转化关系中涉及的三步反应均是化合反应.已知D分子是含有18个电子的异核双原子分子,E是4核10电子分子.下列说法中不正确的是( )
在常温下A、B、C、D、E是5种常见的气体,F是固体,它们之间存在如下的转化关系,转化关系中涉及的三步反应均是化合反应.已知D分子是含有18个电子的异核双原子分子,E是4核10电子分子.下列说法中不正确的是( )| A. | 固体F中含有配位键 | B. | D和E分子间均可形成氢键 | ||
| C. | A、B、C三种分子均属于非极性分子 | D. | E分子中中心原子的杂化类型为sp2 |
16.已知某溶液可能含有NH4+、Na+、Mg2+、Al3+、HCO3-、Cl-、NO2-、SO42-中的几种离子.现取3份,此溶液,分别进行如下实验:
①第1份中滴加盐酸,有气体甲产生;
②第2份中滴加用硝酸酸化后的Ba(NO3)2溶液,有白色沉淀产生,过滤后向滤液中加入AgNO3溶液未见沉淀产生;
③第3份中滴加NaOH溶液,先产生白色沉淀,当沉淀增加到一定量后开始产生气体,最后 沉淀完全溶解.
下列判断正确的是( )
①第1份中滴加盐酸,有气体甲产生;
②第2份中滴加用硝酸酸化后的Ba(NO3)2溶液,有白色沉淀产生,过滤后向滤液中加入AgNO3溶液未见沉淀产生;
③第3份中滴加NaOH溶液,先产生白色沉淀,当沉淀增加到一定量后开始产生气体,最后 沉淀完全溶解.
下列判断正确的是( )
| A. | 气体甲可能为纯净物 | |
| B. | 该溶液中一定存在NH4+、Al3+、NO2-、SO42- | |
| C. | 该溶液中一定不存在Na+、Mg2+、HCO3-、Cl- | |
| D. | 无法确定Na+、HCO3-、NO2-是否存在 |
20.从如表实验事实所得出的相应结论正确的是( )
| 实验事实 | 结论 | |
| ① | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| ② | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| ③ | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| ④ | 常温下白磷可自燃而氮气需在放电时才与氧气反应 | 非金属性:P>N |
| ⑤ | 某白色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液中一定有NH4+ |
| A. | ①②③ | B. | ①③⑤ | C. | ②③⑤ | D. | ③④⑤ |