题目内容
19.实验测得BeCl2为共价化合物,两个Be-Cl键间的夹角应为( )| A. | 60° | B. | 90° | C. | 120° | D. | 180° |
分析 根据BeCl2为共价化合物,Be的化合价为+2价,等于最外层电子数,属于非极性分子来判断键角.
解答 解:BeCl2为共价化合物,Be的化合价为+2价,等于最外层电子数,属于非极性分子,直线型分子,两个Be-Cl键间的夹角为180°,故选D.
点评 本题考查化学键、分子结构与极性判断,比较基础,注意基础知识的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.将甲、乙两种金属的性质相比较,
已知:①甲与H2O反应比乙与H2O反应剧烈;
②甲单质能从乙的盐溶液中置换出单质乙;
③甲的最高价氧化物对应水化物的碱性比乙的最高价氧化物对应水化物的碱性强;
④与非金属单质反应时,甲原子失电子数目比乙原子失电子数目多;
⑤甲单质的熔、沸点比乙的低.
能说明甲的金属性比乙强的是( )
已知:①甲与H2O反应比乙与H2O反应剧烈;
②甲单质能从乙的盐溶液中置换出单质乙;
③甲的最高价氧化物对应水化物的碱性比乙的最高价氧化物对应水化物的碱性强;
④与非金属单质反应时,甲原子失电子数目比乙原子失电子数目多;
⑤甲单质的熔、沸点比乙的低.
能说明甲的金属性比乙强的是( )
| A. | ①④ | B. | ①②③ | C. | ③⑤ | D. | ①②③④⑤ |
10.已知NaHSO2溶液在不同温度下均可被过量KlO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020 mol•L-1的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )
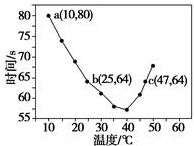

| A. | 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 | |
| B. | 图中a点对应的NaHSO3反应速率为5.0×10-5 mol•L-1•s-1 | |
| C. | 图中b、c两点对应的NaHSO3反应速率相等 | |
| D. | 40℃之后,淀粉不宜用作该实验的指示剂 |
7.四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列有关说法正确的是( )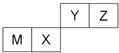

| A. | 离子半径Y<Z<M | |
| B. | Y的最高价氧化物对应水化物的酸性比X的强 | |
| C. | X的最简单气态氢化物的热稳定性比Z的大 | |
| D. | 单质沸点:M>X>Y |
14.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构.则下列叙述正确的是( )
| A. | 原子半径 A>B>D>C | |
| B. | 原子序数 d>c>b>a | |
| C. | 离子半径 C>D>B>A | |
| D. | 原子结构的最外层电子数目 A>B>D>C |
4.下列对HClO分子结构的描述,正确的是( )
| A. | O原子发生sp杂化 | B. | O原子与H、Cl都形成σ键 | ||
| C. | 该分子为直线型分子 | D. | HClO分子的结构式是:H-Cl-O |
8.我国农业因遭受酸雨而造成的损失每年高达15亿多元,为了有效控制酸雨,国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规.下列措施中,你认为减少酸雨产生的途径可采用的是( )
| A. | 少用煤作燃料 | B. | 把工厂烟囱造高 | ||
| C. | 燃烧脱硫煤 | D. | 在已酸化的土壤中加石灰 | ||
| E. | 开发新能源 |
15.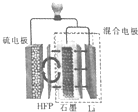 最近加拿大滑铁卢大学的科学家在锂硫(Li-S)电池技术上取得了一项重大突破,一种锂硫电池装置如图所示,其中的聚六氟丙烯(HFP)隔膜只允许Li+通过,已知放电时电池总反应为Li2S6+10Li=6Li2S,下列说法正确的是( )
最近加拿大滑铁卢大学的科学家在锂硫(Li-S)电池技术上取得了一项重大突破,一种锂硫电池装置如图所示,其中的聚六氟丙烯(HFP)隔膜只允许Li+通过,已知放电时电池总反应为Li2S6+10Li=6Li2S,下列说法正确的是( )
 最近加拿大滑铁卢大学的科学家在锂硫(Li-S)电池技术上取得了一项重大突破,一种锂硫电池装置如图所示,其中的聚六氟丙烯(HFP)隔膜只允许Li+通过,已知放电时电池总反应为Li2S6+10Li=6Li2S,下列说法正确的是( )
最近加拿大滑铁卢大学的科学家在锂硫(Li-S)电池技术上取得了一项重大突破,一种锂硫电池装置如图所示,其中的聚六氟丙烯(HFP)隔膜只允许Li+通过,已知放电时电池总反应为Li2S6+10Li=6Li2S,下列说法正确的是( )| A. | 放电时,Li+向负极移动 | |
| B. | 充电时,阳极质量减少,阴极质量增加 | |
| C. | 放电时,正极的电极反应式为S62-+10e-=6S2- | |
| D. | 可用LiCl水溶液代替HFP隔膜 |