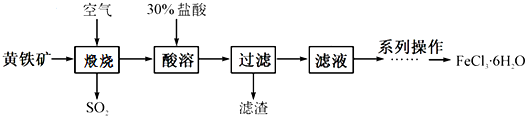
题目内容
13.水溶液中的离子平衡是化学反应原理的重要内容.请回答下列问题:①常温下,0.1mol/LCH3COONa溶液呈碱(填“酸”、“碱”或“中”)性,溶液中c(Na+)>c(CH3COO-)(填“>”、“<”或“=”);
②常温下,在浓度均为0.1mol/L的盐酸和NH4Cl溶液中,水的电离程度大小关系是:0.1mol/L盐酸<0.1mol/LNH4Cl溶液(填“>”、“<”或“=”);
③已知:20℃时,Ksp(AgCl)=1.1×10-10,Ksp(AgBr)=2.0×10-13.将AgCl和AgBr的饱和溶液等体积混合,再逐滴加入足量浓AgNO3溶液,充分反应后,生成沉淀量的关系是:m(AgCl)>m(AgBr)(填“>”、“<”或“=”).
分析 ①醋酸钠是强碱弱酸盐,溶液中醋酸根离子水解溶液显碱性,结合溶液中电荷守恒分析离子浓度大小;
②影响水电离的因素是酸碱抑制水的电离,水解的盐促进水的电离;
③向两饱和溶液中,加入AgNO3,AgCl与AgBr的溶解平衡向左移动,但是饱和溶液中AgBr的溶解度更小,所以溶液中AgCl沉淀较多.
解答 解:①常温下,0.1mol/LCH3COONa溶液中,溶质醋酸钠是强碱弱酸盐,溶液中醋酸根离子水解溶液显碱性,溶液中存在等号守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),溶液显碱性c(H+)<c(OH-),c(Na+)>c(CH3COO-),
故答案为:碱;>;
②常温下,在浓度均为0.1mol/L的盐酸和NH4Cl溶液中,影响水电离的因素是酸碱抑制水的电离,水解的盐促进水的电离,水的电离程度大小关系是0.1mol/L的盐酸<0.1mol/LNH4Cl溶液,故答案为:<;
③在AgCl和AgBr两饱和溶液中,前者c(Ag+)大于后者c(Ag+),c(Cl-)>c(Br-),当将AgCl、AgBr两饱和溶液混合时,发生沉淀的转化,生成更多的AgBr沉淀,与此同时,溶液中n(Cl-)比原来AgCl饱和溶液中大,当加入足量的浓AgNO3溶液时,AgBr沉淀有所增多,但AgCl沉淀增加更多,故答案为:>.
点评 本题考查电解质溶液中离子浓度大小比较,影响水电离平衡的分析判断,难溶电解质的溶解平衡,为高频考点,侧重于学生的分析能力的考查,题目难度中等,解答本题时注意AgCl的溶解度比AgBr大,加入硝酸银,抑制溶解平衡向右移动,生成沉淀更多,题目较简单.

练习册系列答案
相关题目
3.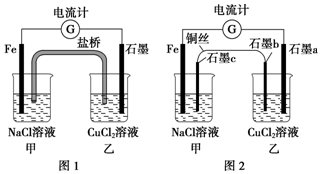 将图1所示装置中的盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转,下列说法不正确的是( )
将图1所示装置中的盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转,下列说法不正确的是( )
 将图1所示装置中的盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转,下列说法不正确的是( )
将图1所示装置中的盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转,下列说法不正确的是( )| A. | 图2中电流计指针偏转方向与图1中相同 | |
| B. | 图2中石墨a上有铜生成 | |
| C. | 向图2中甲装置石墨c附近滴加酚酞试液,出现红色 | |
| D. | 图2中电子流向为Fe→电流计→石墨a→石墨b→铜丝→石墨c→Fe |
4.下列对HClO分子结构的描述,正确的是( )
| A. | O原子发生sp杂化 | B. | O原子与H、Cl都形成σ键 | ||
| C. | 该分子为直线型分子 | D. | HClO分子的结构式是:H-Cl-O |
1.对下列有机反应类型的认识中,错误的是( )
| A. | 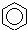 +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$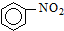 +H2O;取代反应 +H2O;取代反应 | |
| B. | CH4+Cl2→CH3Cl+HCl;置换反应 | |
| C. | CH2=CH2+HCl→CH3-CH2Cl;加成反应 | |
| D. | 2CH3CH2OH+O2$\stackrel{Cu}{→}$2CH3CHO+2H2O;氧化反应 |
8.我国农业因遭受酸雨而造成的损失每年高达15亿多元,为了有效控制酸雨,国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规.下列措施中,你认为减少酸雨产生的途径可采用的是( )
| A. | 少用煤作燃料 | B. | 把工厂烟囱造高 | ||
| C. | 燃烧脱硫煤 | D. | 在已酸化的土壤中加石灰 | ||
| E. | 开发新能源 |
18.分子式为C3H4Cl2的链状有机物有(不考虑立体异构)( )
| A. | 7种 | B. | 6种 | C. | 5种 | D. | 4种 |
9.下列递变情况中,正确的是( )
| A. | Si、P、S元素的最高正价依次降低 | |
| B. | Li、Na、K的原子半径依次增大 | |
| C. | C、O、N的原子半径依次减小 | |
| D. | Na、Mg、Al原子的最外层电子数依次减少 |