题目内容
14.下列实验不能成功的是( )| A. | 将电石和水反应后的气体通入溴水中,如果溴水褪色,证明乙炔和溴发生了反应 | |
| B. | 实验室制溴苯时,将苯与液溴混合后加到有铁丝的反应容器中 | |
| C. | 往酸性KMnO4溶液中通入乙烯来证明乙烯有还原性 | |
| D. | 乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |
分析 A.将电石和水反应后的气体中含有硫化氢、乙炔等气体,硫化氢、乙炔等气体都能和溴发生反应;
B.苯和液溴在溴化铁作催化剂条件下发生取代反应;
C.酸性高锰酸钾溶液具有强氧化性,能氧化还原性气体;
D.饱和碳酸钠溶液能抑制乙酸乙酯溶解,且能和乙酸发生复分解反应.
解答 解:A.将电石和水反应后的气体中含有硫化氢、乙炔等气体,硫化氢、乙炔等气体都能和溴发生反应而使溴水褪色,故A错误;
B.溴和Fe反应生成溴化铁,苯和液溴在溴化铁作催化剂条件下发生取代反应,故B正确;
C.酸性高锰酸钾溶液具有强氧化性,能氧化还原性气体,所以可以往酸性KMnO4溶液中通入乙烯来证明乙烯有还原性,故C正确;
D.饱和碳酸钠溶液能抑制乙酸乙酯溶解,且能和乙酸发生复分解反应生成乙酸钠、二氧化碳和水,所以乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去,故D正确;
故选A.
点评 本题考查化学实验方案评价,为高考高频点,涉及气体制备、取代反应、除杂、氧化还原反应等知识点,明确实验原理是解本题关键,易错选项是A.

练习册系列答案
相关题目
2.下列各组中的反应,属于同一反应类型的是( )
| A. | 乙烯水化制乙醇;溴乙烷水解制乙醇 | |
| B. | 甲苯使酸性高锰酸钾溶液褪色;丙炔和氢气反应制取丙烷 | |
| C. | 甲苯硝化制TNT;乙炔与氯化氢反应制氯乙烯 | |
| D. | 乙醇脱水制乙烯;溴乙烷脱溴化氢制乙烯 |
9.将甲、乙两种金属的性质相比较,
已知:①甲与H2O反应比乙与H2O反应剧烈;
②甲单质能从乙的盐溶液中置换出单质乙;
③甲的最高价氧化物对应水化物的碱性比乙的最高价氧化物对应水化物的碱性强;
④与非金属单质反应时,甲原子失电子数目比乙原子失电子数目多;
⑤甲单质的熔、沸点比乙的低.
能说明甲的金属性比乙强的是( )
已知:①甲与H2O反应比乙与H2O反应剧烈;
②甲单质能从乙的盐溶液中置换出单质乙;
③甲的最高价氧化物对应水化物的碱性比乙的最高价氧化物对应水化物的碱性强;
④与非金属单质反应时,甲原子失电子数目比乙原子失电子数目多;
⑤甲单质的熔、沸点比乙的低.
能说明甲的金属性比乙强的是( )
| A. | ①④ | B. | ①②③ | C. | ③⑤ | D. | ①②③④⑤ |
19.下列各组有机物,不论以何种比值混合,只要二者物质的量之和不变,完全燃烧时所消耗的氧气的物质的量和生成的水的物质的量分别相等的是( )
| A. | 甲烷和乙醇 | B. | 乙烷和乙醇 | C. | 苯和苯甲酸 | D. | 乙炔和苯 |
6.下列说法正确的是( )
| A. | 第IA族的金属单质与水反应一定比第ⅡA族的金属单质剧烈 | |
| B. | 第二周期元素的最高正价和最低负价的绝对值之和等于8 | |
| C. | 同周期主族元素的原子形成简单离子的电子层结构相同 | |
| D. | 元素原子的最外层电子数的多少与其非金属性的强弱无必然联系 |
3.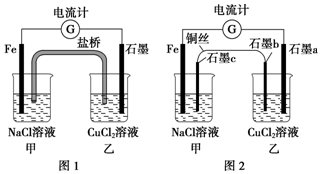 将图1所示装置中的盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转,下列说法不正确的是( )
将图1所示装置中的盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转,下列说法不正确的是( )
 将图1所示装置中的盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转,下列说法不正确的是( )
将图1所示装置中的盐桥换成铜导线与两石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转,下列说法不正确的是( )| A. | 图2中电流计指针偏转方向与图1中相同 | |
| B. | 图2中石墨a上有铜生成 | |
| C. | 向图2中甲装置石墨c附近滴加酚酞试液,出现红色 | |
| D. | 图2中电子流向为Fe→电流计→石墨a→石墨b→铜丝→石墨c→Fe |
4.下列对HClO分子结构的描述,正确的是( )
| A. | O原子发生sp杂化 | B. | O原子与H、Cl都形成σ键 | ||
| C. | 该分子为直线型分子 | D. | HClO分子的结构式是:H-Cl-O |