题目内容
16.已知某溶液可能含有NH4+、Na+、Mg2+、Al3+、HCO3-、Cl-、NO2-、SO42-中的几种离子.现取3份,此溶液,分别进行如下实验:①第1份中滴加盐酸,有气体甲产生;
②第2份中滴加用硝酸酸化后的Ba(NO3)2溶液,有白色沉淀产生,过滤后向滤液中加入AgNO3溶液未见沉淀产生;
③第3份中滴加NaOH溶液,先产生白色沉淀,当沉淀增加到一定量后开始产生气体,最后 沉淀完全溶解.
下列判断正确的是( )
| A. | 气体甲可能为纯净物 | |
| B. | 该溶液中一定存在NH4+、Al3+、NO2-、SO42- | |
| C. | 该溶液中一定不存在Na+、Mg2+、HCO3-、Cl- | |
| D. | 无法确定Na+、HCO3-、NO2-是否存在 |
分析 第3份中滴加NaOH溶液,先产生白色沉淀,当沉淀增加到一定量后开始产生气体,最后 沉淀完全溶解,说明含有NH4+、Al3+,不含Mg2+、不含HCO3-,由此可知①第1份中滴加盐酸,有气体甲产生,气体肯定不是二氧化碳,应含有NO2-,发生氧化还原反应生成氮气,
第2份中滴加用硝酸酸化后的Ba(NO3)2溶液,有白色沉淀产生,过滤后向滤液中加入AgNO3溶液未见沉淀产生,则存在SO42-,没有Cl-,以此解答该题.
解答 解:第3份中滴加NaOH溶液,先产生白色沉淀,当沉淀增加到一定量后开始产生气体,最后 沉淀完全溶解,说明含有NH4+、Al3+,不含Mg2+、不含HCO3-,由此可知①第1份中滴加盐酸,有气体甲产生,气体肯定不是二氧化碳,应含有NO2-,发生氧化还原反应生成氮气,第2份中滴加用硝酸酸化后的Ba(NO3)2溶液,有白色沉淀产生,过滤后向滤液中加入AgNO3溶液未见沉淀产生,则存在SO42-,没有Cl-,
A.含有NO2-,酸性条件下发生反应生成气体甲,可能生成氮气、NO、氯气等,为混合物,故A错误;
B.由以上分析可知该溶液中一定存在NH4+、Al3+、NO2-、SO42-,故B正确;
C.不能确定是否含有Na+,应通过焰色反应检验,故C错误;
D.因含有Al3+,则一定不含HCO3-,二者发生互促水解反应,故D错误.
故选B.
点评 本题考查了常见离子的检验,为高频考点,侧重于学生的分析能力的考查,注意明确常见离子的性质及检验的方法,特别是熟悉具有特殊现象的离子,判断离子是否存在时,一定排除干扰离子,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.下列说法正确的是( )
| A. | 第IA族的金属单质与水反应一定比第ⅡA族的金属单质剧烈 | |
| B. | 第二周期元素的最高正价和最低负价的绝对值之和等于8 | |
| C. | 同周期主族元素的原子形成简单离子的电子层结构相同 | |
| D. | 元素原子的最外层电子数的多少与其非金属性的强弱无必然联系 |
7.四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列有关说法正确的是( )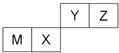

| A. | 离子半径Y<Z<M | |
| B. | Y的最高价氧化物对应水化物的酸性比X的强 | |
| C. | X的最简单气态氢化物的热稳定性比Z的大 | |
| D. | 单质沸点:M>X>Y |
4.下列对HClO分子结构的描述,正确的是( )
| A. | O原子发生sp杂化 | B. | O原子与H、Cl都形成σ键 | ||
| C. | 该分子为直线型分子 | D. | HClO分子的结构式是:H-Cl-O |
1.对下列有机反应类型的认识中,错误的是( )
| A. | 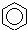 +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$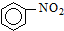 +H2O;取代反应 +H2O;取代反应 | |
| B. | CH4+Cl2→CH3Cl+HCl;置换反应 | |
| C. | CH2=CH2+HCl→CH3-CH2Cl;加成反应 | |
| D. | 2CH3CH2OH+O2$\stackrel{Cu}{→}$2CH3CHO+2H2O;氧化反应 |
8.我国农业因遭受酸雨而造成的损失每年高达15亿多元,为了有效控制酸雨,国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规.下列措施中,你认为减少酸雨产生的途径可采用的是( )
| A. | 少用煤作燃料 | B. | 把工厂烟囱造高 | ||
| C. | 燃烧脱硫煤 | D. | 在已酸化的土壤中加石灰 | ||
| E. | 开发新能源 |
12.下列说法正确的是( )
| A. | 利用一束强光照射明矾溶液,产生光亮的“通路”,说明明矾一定发生了水解 | |
| B. | 与Al反应放出H2的溶液中Mg2-、Ca2-、HCO3-、NO3-有可能大量共存 | |
| C. | Ca(ClO)2溶液中通入过量SO2的离子方程式:ClO-+SO2+H2O=HClO+HSO3- | |
| D. | 等体积、等物质的量浓度的NaX的弱酸HX混合后的溶液中c(Na+)>c(HX)>c(H+)>c(OH-) |