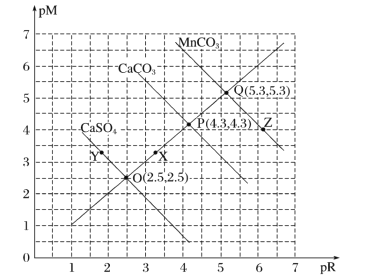
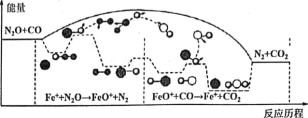
题目内容
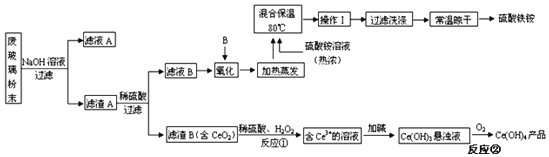
【题目】下面是某科研小组利用废铁屑还原浸出软锰矿(主要成分为MnO2)制备硫酸锰及电解其溶液制锰的工艺流程图:
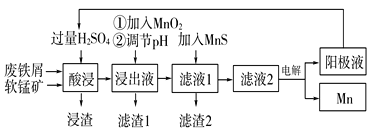
已知:①浸出液中主要含有Fe3+、Fe2+、Co2+、Ni2+等杂质金属离子;
②生成氢氧化物的pH见下表:
物质 | Fe(OH)2 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
开始沉淀的pH | 7.5 | 2.7 | 7.7 | 7.6 | 8.3 |
完全沉淀的pH | 9.7 | 3.7 | 8.4 | 8.2 | 9.8 |
请回答下列问题:
(1)“酸浸”前将原料粉碎的目的是____。
(2)流程图中“①加入MnO2”的作用____,MnO2还可以用其他试剂____(填化学式)代替。
(3)流程图中“②调节pH”可以除去某种金属离子,应将溶液pH调节控制的范围是___~7.6。上述流程中,能循环使用的一种物质是___(填化学式)。
(4)向滤液Ⅰ中加入MnS的作用是除去Co2+、Ni2+等离子,其中可以发生反应为MnS(s)+Ni2+(aq)=NiS(s)+Mn2+(aq)等。当该反应完全后,滤液2中的Mn2+与Ni2+的物质的量浓度之比是___[已知Ksp(MnS)=2.8×10-10,Ksp(NiS)=2.0×10-21]。
(5)在适当条件下,在MnSO4、H2SO4和H2O为体系的电解液中电解也可获得MnO2,其阳极电极反应式为____。
(6)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___。
时,z=___。
【答案】增大反应物的接触面积,增大反应速率 将浸出液中的Fe2+氧化为Fe3+ H2O2 3.7 H2SO4 1.4×1011 Mn2++2H2O-2e-=MnO2+4H+ ![]()
【解析】
用软锰矿还原酸浸制取硫酸锰电解液并进一步提炼金属锰,软锰矿和废铁屑加入过量硫酸浸出,过滤,浸出液中主要含有Fe3+、Fe2+、Co2+、Ni2+等金属离子,加入MnO2的作用是将浸出液中的Fe2+氧化为Fe3+,同时自身被还原为Mn2+,加入氨水调节溶液的pH以除去铁离子,过滤后的滤液中加入MnS净化除去Co2+、Ni2+等,过滤得到滤液电解得到金属锰和阳极液,阳极液中的硫酸循环使用,滤渣2为MnS、CoS、NiS,据此分析解题。
(1)“酸浸”前将原料粉碎,增大了反应物的接触面积,从而加快反应速率;
(2)流程图中“①加入MnO2”的作用是将浸出液中的Fe2+氧化为Fe3+,同时自身被还原为Mn2+,MnO2作氧化剂,可以用试剂H2O2代替;
(3)流程图中“②调节pH”可以除去铁离子,由表中数据可知:Fe3+完全沉淀时的溶液pH=3.7,则应将溶液pH调节控制的范围是3.7~7.6;上述工艺中,能循环使用的一种物质是电解过程中阳极液含的H2SO4;
(4)Ksp(MnS)=2.8×10-10,Ksp(NiS)=2.0×10-21],沉淀转化的方程式为:MnS+Ni2+=NiS+Mn2+,则Mn2+与Ni2+离子的物质的量浓度之比=c(Mn2+):c(Ni2+)=Ksp(MnS):Ksp(NiS)=2.8×10-10:2.0×10-21=1.4×1011;
(5)在适当条件下,在MnSO4电解在阳极失去电子获得MnO2,其阳极电极反应式为:Mn2++2H2O-2e-═MnO2+4H+;
(6)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Ni、Co、Mn的化合价分别为+2、+3、+4.当x=y=![]() 时,该化合物中各元素的化合价代数和为0,+1+(+2)×
时,该化合物中各元素的化合价代数和为0,+1+(+2)×![]() +(+3)×
+(+3)×![]() +(+4)×z+(-2)×2=0,z=
+(+4)×z+(-2)×2=0,z=![]() 。
。

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
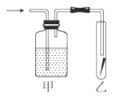
一线名师口算应用题天天练一本全系列答案【题目】Ⅰ.在测定空气里氧气含量的实验中,小明采用了如图所用的装置:
装置一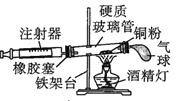 装置二
装置二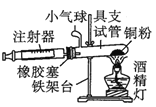
在由注射器和硬质玻璃管组成的密闭系统中留有40mL空气,给装有铜粉的玻璃管加热,观察密闭系统内空气体积变化。
(1)在实验加热过程中,缓慢推动注射器活塞的目的是__________。
(2)装置一比装置二更______(填“合理”或“不合理”),理由是_________。
(3)小明测得的实验结果如下:
反应前注射器内气体总体积 | 反应后注射器内气体总体积 |
15mL | 10mL |
由此数据可推算出他测定的氧气的体积分数________21%(填“>”“<”或“=”),造成该实验出现误差的原因可能是____________(填序号)。
①推动注射器活塞速度太快 ②未冷却至室温就读数 ③加入铜粉量太少
Ⅱ.H2O2分解速率受多种因素影响。实验测得70 ℃时不同条件下H2O2浓度随时间的变化如图所示。
图甲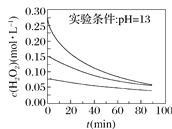 图乙
图乙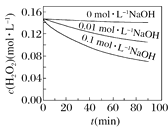
(4)根据上图,将不同条件对速率的影响情况补充完整:图甲表明,____________,H2O2分解速率越快;图乙表明,_________,H2O2分解速率越快。