题目内容
【题目】某温度(T℃)时,水的离子积为Kw=1×10-13。若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比。
(1)若所得混合溶液为中性,则a∶b=__;此溶液中各离子的浓度由大到小的排列顺序是_____。
(2)若所得混合溶液的pH=2,则a∶b=____;此溶液中各种离子的浓度由大到小的排列顺序是______。
【答案】10∶1 c(Na+)>c(SO42—)>c(H+)=c(OH-) 9∶2 c(H+)>c(SO42—)>c(Na+)>c(OH-)
【解析】
若将此温度(T℃)下,pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合,此时NaOH溶液中,c(H+)=10-11 mol/L ,c(OH-)=![]() mol/L=0.01mol/L,c(Na+)=0.01mol/L,稀硫酸溶液中c(H+)=0.1mol/L,c(SO42-)=0.05 mol/L;
mol/L=0.01mol/L,c(Na+)=0.01mol/L,稀硫酸溶液中c(H+)=0.1mol/L,c(SO42-)=0.05 mol/L;
(1)若所得混合液为中性,则有n(OH-)= n(H+),即0.01a=0.1b,a:b=10:1,混合溶液呈中性,则c(OH-)= c(H+),根据电荷守恒得c(Na+)+ c(H+)= c(OH-)+2 c(SO42-) ,则c(Na+)>c(SO42-),该溶液为盐溶液,硫酸根离子浓度大于氢离子浓度,所以离子浓度大小顺序是:c(Na+)>c(SO42—)>c(H+)=c(OH-),
故答案为:10:1; c(Na+)>c(SO42—)>c(H+)=c(OH-);
②若所得混合液的pH=2,c(H+)=0.01 mol/L,硫酸过量,则有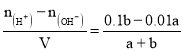 =0.01,解得:a:b=9:2;溶液呈酸性,则:c(H+)>c(OH),溶液中氢离子浓度为0.01mol/L,硫酸根离子浓度为:
=0.01,解得:a:b=9:2;溶液呈酸性,则:c(H+)>c(OH),溶液中氢离子浓度为0.01mol/L,硫酸根离子浓度为:![]() mol/L=0.009mol/L,所以氢离子浓度大于硫酸根离子浓度,根据物料守恒知,c(SO42—)> c(Na+),氢氧根离子来自于水,浓度最小,此溶液中各种离子的浓度由大到小的排列顺序是c(H+)>c(SO42-)>c(Na+)>c(OH-);
mol/L=0.009mol/L,所以氢离子浓度大于硫酸根离子浓度,根据物料守恒知,c(SO42—)> c(Na+),氢氧根离子来自于水,浓度最小,此溶液中各种离子的浓度由大到小的排列顺序是c(H+)>c(SO42-)>c(Na+)>c(OH-);
故答案为:9:2;c(H+)>c(SO42-)>c(Na+)>c(OH-)。

【题目】下面是某科研小组利用废铁屑还原浸出软锰矿(主要成分为MnO2)制备硫酸锰及电解其溶液制锰的工艺流程图:
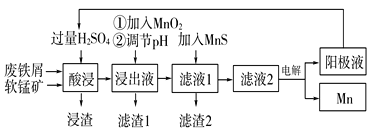
已知:①浸出液中主要含有Fe3+、Fe2+、Co2+、Ni2+等杂质金属离子;
②生成氢氧化物的pH见下表:
物质 | Fe(OH)2 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
开始沉淀的pH | 7.5 | 2.7 | 7.7 | 7.6 | 8.3 |
完全沉淀的pH | 9.7 | 3.7 | 8.4 | 8.2 | 9.8 |
请回答下列问题:
(1)“酸浸”前将原料粉碎的目的是____。
(2)流程图中“①加入MnO2”的作用____,MnO2还可以用其他试剂____(填化学式)代替。
(3)流程图中“②调节pH”可以除去某种金属离子,应将溶液pH调节控制的范围是___~7.6。上述流程中,能循环使用的一种物质是___(填化学式)。
(4)向滤液Ⅰ中加入MnS的作用是除去Co2+、Ni2+等离子,其中可以发生反应为MnS(s)+Ni2+(aq)=NiS(s)+Mn2+(aq)等。当该反应完全后,滤液2中的Mn2+与Ni2+的物质的量浓度之比是___[已知Ksp(MnS)=2.8×10-10,Ksp(NiS)=2.0×10-21]。
(5)在适当条件下,在MnSO4、H2SO4和H2O为体系的电解液中电解也可获得MnO2,其阳极电极反应式为____。
(6)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___。
时,z=___。
【题目】某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,原因是(用离子方程式表示):___。
(2)调节pH,实验记录如下:
实验序号 | pH | 实验现象 |
a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液。
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应。
该学生对产生的白色沉淀提出了两种假设:
①白色沉淀为Ag2SO3。
②白色沉淀为Ag2SO4,推测的依据是___。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4。实验方法是:另取Ag2SO4固体置于__溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化。
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体。
Ⅲ.分别用Ba(NO3)2、BaCl2溶液检验Ⅱ中反应后的溶液,前者无明显变化,后者产生白色沉淀。
①实验Ⅰ的目的是___。
②根据实验现象分析,X的成分是___。
③Ⅱ中反应的化学方程式是___。
(5)该同学综合以上实验,分析产生X的原因:随着酸性的增强,体系的还原性增强。