题目内容
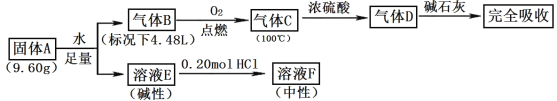
【题目】平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题以此粉末为原料,设计如图工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵:
已知:①酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce3+易水解,Ce4+有较强氧化性。
②CeO2不溶于稀硫酸。
③硫酸铁铵[aFe2(SO4)3b(NH4)2SO4cH2O]广泛用于水的净化处理。
(1)在氧化环节,下列物质中最适合用作氧化剂B的是___(填序号)。
a.NaClO b.H2O2 c.KMnO4
(2)操作Ⅰ的名称是___,检验硫酸铁铵溶液中含有NH4+的方法是___。
(3)写出反应②的化学方程式___。
(4)称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/LBa(NO3)2溶液100mL,恰好完全反应。通过计算,该硫酸铁铵的化学式为___(写出必要的计算步骤,否则不得分)。
【答案】B 冷却结晶 取少量样品与试管中加入NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,若试纸变蓝,即可证明 4Ce(OH)3+O2+4H2O=4Ce(OH)4 Fe2(SO4)32(NH4)2SO42H2O
【解析】
废玻璃粉末加氢氧化钠溶液后过滤,得到滤渣A的成分是Fe2O3、CeO2、FeO;滤渣A(Fe2O3、CeO2、FeO)加稀硫酸后过滤得滤液B是硫酸亚铁溶液,加入氧化剂C可生成硫酸铁,所加氧化剂应避免引入新杂质,滤渣B的成分是CeO2;CeO2与H2O2和稀H2SO4反应生成Ce3+和O2;Ce3+加碱生成Ce(OH)3悬浊液;Ce(OH)3悬浊液被氧化生成Ce(OH)4。
(1)根据流程在氧化环节为加入氧化剂B氧化硫酸亚铁,为不引入新杂质,选用过氧化氢最为合适;故答案为B;
(2)硫酸铁溶液,加入硫酸铵溶液混合保温80℃反应,加热蒸发后,经过冷却结晶、过滤洗涤、常温晾干得到硫酸铁铵;检验硫酸铁铵溶液中含有NH4+的方法是:取少量样品与试管中加入NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,若试纸变蓝,即可证明;
(3)反应②为Ce(OH)3悬浊液被氧化生成Ce(OH)4,反应为:4Ce(OH)3+O2+4H2O=4Ce(OH)4;
(4)称取14.00g样品,将其溶于水配置成100mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到沉淀并烘干灼烧至恒重得到1.60g固体为氧化铁,n(Fe2O3)=![]() =0.01mol,生成氢氧化铁沉淀物质的量为,n(Fe(OH)3)=0.02mol,向另一份溶液中加入0.05mol Ba(NO3)2溶液,恰好完全反应,则n(SO42﹣)=0.05mol,所以14.00g样品中含有Fe2(SO4)30.02mol,n(SO42﹣)为0.1mol,则(NH4)2SO4为0.1mol﹣0.02mol×3=0.04mol,则m(H2O)=14.00g﹣0.02mol×400g/mol﹣0.04mol×132g/mol=0.72g,n(H2O)=
=0.01mol,生成氢氧化铁沉淀物质的量为,n(Fe(OH)3)=0.02mol,向另一份溶液中加入0.05mol Ba(NO3)2溶液,恰好完全反应,则n(SO42﹣)=0.05mol,所以14.00g样品中含有Fe2(SO4)30.02mol,n(SO42﹣)为0.1mol,则(NH4)2SO4为0.1mol﹣0.02mol×3=0.04mol,则m(H2O)=14.00g﹣0.02mol×400g/mol﹣0.04mol×132g/mol=0.72g,n(H2O)=![]() =0.04mol,n(Fe2(SO4)3):n((NH4)2SO4):n(H2O)=0.02:0.04:0.04=1:2:2,所以化学式为Fe2(SO4)32(NH4)2SO42H2O。
=0.04mol,n(Fe2(SO4)3):n((NH4)2SO4):n(H2O)=0.02:0.04:0.04=1:2:2,所以化学式为Fe2(SO4)32(NH4)2SO42H2O。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案【题目】下面是某科研小组利用废铁屑还原浸出软锰矿(主要成分为MnO2)制备硫酸锰及电解其溶液制锰的工艺流程图:
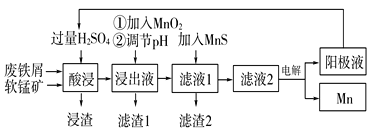
已知:①浸出液中主要含有Fe3+、Fe2+、Co2+、Ni2+等杂质金属离子;
②生成氢氧化物的pH见下表:
物质 | Fe(OH)2 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
开始沉淀的pH | 7.5 | 2.7 | 7.7 | 7.6 | 8.3 |
完全沉淀的pH | 9.7 | 3.7 | 8.4 | 8.2 | 9.8 |
请回答下列问题:
(1)“酸浸”前将原料粉碎的目的是____。
(2)流程图中“①加入MnO2”的作用____,MnO2还可以用其他试剂____(填化学式)代替。
(3)流程图中“②调节pH”可以除去某种金属离子,应将溶液pH调节控制的范围是___~7.6。上述流程中,能循环使用的一种物质是___(填化学式)。
(4)向滤液Ⅰ中加入MnS的作用是除去Co2+、Ni2+等离子,其中可以发生反应为MnS(s)+Ni2+(aq)=NiS(s)+Mn2+(aq)等。当该反应完全后,滤液2中的Mn2+与Ni2+的物质的量浓度之比是___[已知Ksp(MnS)=2.8×10-10,Ksp(NiS)=2.0×10-21]。
(5)在适当条件下,在MnSO4、H2SO4和H2O为体系的电解液中电解也可获得MnO2,其阳极电极反应式为____。
(6)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___。
时,z=___。