题目内容
【题目】元素周期表是指导我们系统学习化学的重要工具。(答案都填写化学式)
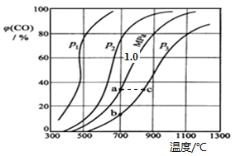
(1)如图是铁元素在元素周期表中的有关信息。

写出Fe的原子结构示意图__,自然界中存在的54Fe和56Fe,它们互称为___。将铁片放入冷浓硫酸中,片刻后将铁片移入硫酸铜溶液中,发现铁片表面无明显变化,原因是__。通常证明某溶液中含Fe2+的化学方法是___。
下表是元素周期表的一部分:
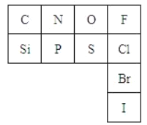
(2)从原子结构角度分析,C、N、O、F四种元素处于同一行,是由于它们的__相同。处于同一列的N和P位于元素周期表的__族。
(3)通过元素周期表,我们可以知道:
①氮元素的最低化合价为_,其气态氢化物的结构式为__。
②与硅元素处于同一周期,两性金属元素是__,并写出其在元素周期表中的位置:第__周期,__族,该元素的最高价氧化物对应水化物的电离方程式为__。
③第三周期半径最大的金属元素__,该元素形成氢氧化物的电子式_,检验物质中是否含有该元素的方法是:__。
④在上表所列元素的最高价氧化物对应水化物中酸性最强的是__(写化学式)。该元素与硫元素相比,非金属性较强的元素是__(填元素符号),请写出证明该结论的一个实验事实:__。
⑤如图,将潮湿的Cl2单质通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试剂可能是___。
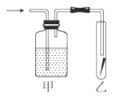
a.浓硫酸 b.NaOH溶液 c.KI溶液 d.饱和食盐水
⑥由于氢元素的化合价,有人提议还可以将其放在第__族,又有人提议可将它放在周期表中第IVA族,这样建议的原因是__。
⑦科学家通过对某些元素的化合价进行研究,寻找高效农药。这些元素往往位于元素周期表的__(选填序号)。
a.左下角区域 b.右上角区域 c.左上角区域 d.右下角区域
【答案】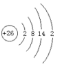 同位素 铁片在浓硫酸中发生钝化,表面覆盖有一层致密的氧化膜,阻止其与硫酸铜溶液发生反应 取样,向其中滴加KSCN溶液,无明显变化,滴加氯水,溶液变成血红色,则含Fe2+ 核外电子层数 VA -3
同位素 铁片在浓硫酸中发生钝化,表面覆盖有一层致密的氧化膜,阻止其与硫酸铜溶液发生反应 取样,向其中滴加KSCN溶液,无明显变化,滴加氯水,溶液变成血红色,则含Fe2+ 核外电子层数 VA -3 ![]() Al 三 IIIA H++AlO2-+H2O
Al 三 IIIA H++AlO2-+H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH- Na
Al3++3OH- Na ![]() 焰色反应呈黄色 HClO4 Cl 氯气通入硫化钠溶液中产生淡黄色沉淀 abc VIIA 其最高正价与最低负价的绝对值相等 b
焰色反应呈黄色 HClO4 Cl 氯气通入硫化钠溶液中产生淡黄色沉淀 abc VIIA 其最高正价与最低负价的绝对值相等 b
【解析】
(1)常温下,Fe和浓硫酸发生钝化现象;亚铁离子和KSCN溶液不反应,铁离子和KSCN溶液反应生成络合物而使溶液呈血红色;
(1)Fe的核电荷数为26,原子核外共有26个电子,其原子结构示意图为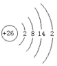 ;自然界中存在的54Fe和56Fe,它们的质子数相同,中子数不等,互称为同位素;常温下,Fe和浓硫酸反应生成一层致密的氧化物薄膜而阻止进一步反应,所以铁片表面无变化,该现象为钝化;亚铁离子和KSCN溶液不反应,铁离子和KSCN溶液反应生成络合物而使溶液呈血红色,所以亚铁离子的检验方法为:取样滴加 KSCN 溶液,溶液无明显变化,再滴加氯水,出现血红色,证明含 Fe2+;
;自然界中存在的54Fe和56Fe,它们的质子数相同,中子数不等,互称为同位素;常温下,Fe和浓硫酸反应生成一层致密的氧化物薄膜而阻止进一步反应,所以铁片表面无变化,该现象为钝化;亚铁离子和KSCN溶液不反应,铁离子和KSCN溶液反应生成络合物而使溶液呈血红色,所以亚铁离子的检验方法为:取样滴加 KSCN 溶液,溶液无明显变化,再滴加氯水,出现血红色,证明含 Fe2+;
(2)从原子结构角度分析,C、N、O、F四种元素处于同一行,是由于它们的电子层相同.N和P处于同一列,因为它们的最外层电子数相同,它们都位于元素周期表的第VA族;
(3)①氮元素的最低化合价为+5,最低价为-3价,其气态氢化物的结构式为![]() ;
;
②硅元素处于元素周期表的第三周期,同周期的两性金属元素是Al元素,其在元素周期表中的位置是第三周期,IIIA族,该元素的最高价氧化物对应水化物Al(OH)3的电离方程式为H++AlO2-+H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH-;
Al3++3OH-;
③同周期的主族元素,随核电荷数的增大,原子半径依次减小,则第三周期半径最大的金属元素Na元素,该元素形成氢氧化钠的电子式为![]() ,利用焰色反应检验物质中是否含有该元素,钠元素焰色反应呈黄色;
,利用焰色反应检验物质中是否含有该元素,钠元素焰色反应呈黄色;
④元素的非金属性越强,其最高价氧化物水化物的酸性越强,在上表所列元素除F、O无正价外,Cl元素的非金属性最强,则最高价氧化物对应水化物中酸性最强的是HClO4;将氯气通入硫化钠溶液中产生淡黄色沉淀,说明Cl2的氧化性比S强,即氯元素的非金属性比硫元素强;
⑤最终红色布条不褪色,说明甲装置内盛放的液体应与氯气发生反应或可以干燥氯气,NaOH溶液、KI溶液能与氯气反应,浓硫酸干燥氯气,饱和氯化钠溶液不能完全吸收氯气,故答案为abc;
⑥由于氢元素可形成NaH,氢元素显-1价,则有人提议可将氢元素放在VIIA族;根据最高正价与最低负价的绝对值相等,又可将氢元素放在周期表中的ⅣA族;
⑦科学家通过对某些元素的化合价进行研究,发现通常制造的农药含有F、Cl、S、P等元素,这些元素位于元素周期表的右上角区域,故答案为b。

【题目】下面是某科研小组利用废铁屑还原浸出软锰矿(主要成分为MnO2)制备硫酸锰及电解其溶液制锰的工艺流程图:
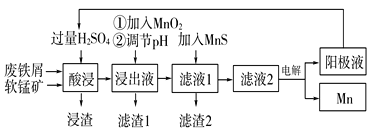
已知:①浸出液中主要含有Fe3+、Fe2+、Co2+、Ni2+等杂质金属离子;
②生成氢氧化物的pH见下表:
物质 | Fe(OH)2 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
开始沉淀的pH | 7.5 | 2.7 | 7.7 | 7.6 | 8.3 |
完全沉淀的pH | 9.7 | 3.7 | 8.4 | 8.2 | 9.8 |
请回答下列问题:
(1)“酸浸”前将原料粉碎的目的是____。
(2)流程图中“①加入MnO2”的作用____,MnO2还可以用其他试剂____(填化学式)代替。
(3)流程图中“②调节pH”可以除去某种金属离子,应将溶液pH调节控制的范围是___~7.6。上述流程中,能循环使用的一种物质是___(填化学式)。
(4)向滤液Ⅰ中加入MnS的作用是除去Co2+、Ni2+等离子,其中可以发生反应为MnS(s)+Ni2+(aq)=NiS(s)+Mn2+(aq)等。当该反应完全后,滤液2中的Mn2+与Ni2+的物质的量浓度之比是___[已知Ksp(MnS)=2.8×10-10,Ksp(NiS)=2.0×10-21]。
(5)在适当条件下,在MnSO4、H2SO4和H2O为体系的电解液中电解也可获得MnO2,其阳极电极反应式为____。
(6)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___。
时,z=___。