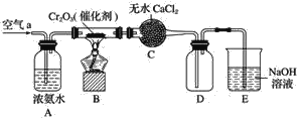
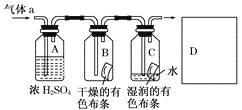
题目内容
【题目】标准状况下将3.36 L硫化氢通入含一定量的氢氧化钠溶液中全部吸收,氢氧化钠也全部反应,然后在低温下小心蒸发,得到不含结晶水的固体10.6 g,问所得固体中含有什么物质__________?其质量各为多少克__________?
【答案】Na2S和NaHS的混合物 m(Na2S)=7.8g,m(NaHS)=2.8 g
【解析】
标准状况下将3.36L硫化氢气体的物质的量n=![]() =
=![]() =0.15mol,由于硫化氢被完全吸收,而且氢氧化钠也全部反应,故所得的固体物质可能是Na2S或NaHS或两者的混合物,根据硫原子的守恒和最后所得固体的质量,列方程组即可求解。
=0.15mol,由于硫化氢被完全吸收,而且氢氧化钠也全部反应,故所得的固体物质可能是Na2S或NaHS或两者的混合物,根据硫原子的守恒和最后所得固体的质量,列方程组即可求解。
标准状况下,3.36 L硫化氢气体的物质的量n=![]() =
=![]() =0.15 mol,由于硫化氢被完全吸收,而且氢氧化钠也全部反应,故所得的固体物质可能是Na2S或NaHS或两者的混合物。
=0.15 mol,由于硫化氢被完全吸收,而且氢氧化钠也全部反应,故所得的固体物质可能是Na2S或NaHS或两者的混合物。
设所得的固体产物中Na2S为xmol,NaHS为ymol
根据硫原子的守恒:x+y=0.15 mol ①
根据所得固体质量:78x+56y=10.6 g ②
解得x=0.1 mol,y=0.05 mol。
故Na2S的质量m=nM=0.1 mol×78 g·mol-1=7.8g,
NaHS的质量m=nM=0.05 mol×56 g·mol-1=2.8 g,
故答案为:Na2S和NaHS的混合物;m(Na2S)=7.8g,m(NaHS)=2.8 g

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】下表中列出了25 ℃、101 kPa时一些物质的燃烧热数据:
物质 | CH4(g) | CH3OCH3(g) | H2(g) | HC≡CH(g) |
燃烧热/(kJ·mol-1) | 890.3 | 1 453.0 | 285.8 | 1 299.6 |
已知:①1 mol液态水变为气态水要吸收44.0 kJ的热量;
②键能:C—H键 413.4 kJ·mol-1、H—H键 436.0 kJ·mol-1。
下列叙述错误的是
A. CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-1 453.0 kJ·mol-1
B. C≡C键的键能为786.0 kJ·mol-1
C. 2CH4(g)+O2(g)=CH3OCH3(g)+H2O(g) ΔH=-283.6 kJ·mol-1
D. H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
【题目】自然界中存在大量的元素,如钠、镁、铝、铁、铜、砷、锌、镍等在生活中有着广泛的应用。
(1)请写出Fe的基态原子核外电子排布式________,砷属于________区元素。
(2)金属A的原子只有3个电子层,其第一至第四电离能如下:
电离能 |
|
|
|
|
A | 932 | 1821 | 15390 | 21771 |
则A原子的价电子排布式为___________________________。
(3)锌化铜是一种金属互化物,其化学式有多种形式,如![]() ,
,![]() ,
,![]() 等。其中所含元素铜的第二电离能________(填“大于”“小于”或“等于”)锌的第二电离能。
等。其中所含元素铜的第二电离能________(填“大于”“小于”或“等于”)锌的第二电离能。
(4)用锌还原![]() 的盐酸溶液,经后续处理可制得绿色的晶体
的盐酸溶液,经后续处理可制得绿色的晶体![]() 。该晶体所含元素中,电负性最大的元素是________,与Ti形成配位键的配体是________,
。该晶体所含元素中,电负性最大的元素是________,与Ti形成配位键的配体是________,![]() 该配合物中含有
该配合物中含有![]() 键的数目为________。
键的数目为________。
(5)![]() 能形成多种配离子,如
能形成多种配离子,如![]() ,
,![]() 等。
等。![]() 的空间构型为:________;与
的空间构型为:________;与![]() 互为等电子体的分子有:___________________(填分子式)。
互为等电子体的分子有:___________________(填分子式)。
(6)铜的化合物种类很多,如图是氯化亚铜的晶胞结构(黑色球表示![]() ,白色球表示
,白色球表示![]() ),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ=________
),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ=________![]() (用
(用![]() 表示阿伏加德罗常数)
表示阿伏加德罗常数)