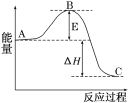
题目内容
【题目】标准状况下氯气和氢气共aL,在光照下充分进行反应,反应后的气体恰好能使bmol 氢氧化钠完全转化成盐,则a、b的关系不可能是下列的( )
A. b<![]() B. b<
B. b<![]() C. b>
C. b>![]() D. b>
D. b>![]()
【答案】D
【解析】
H2和Cl2的混合气体aL经光照反应后所得气体,恰好能与b mol的NaOH完全作用生成盐,生成的盐可能是NaCl或NaCl和NaClO两种情况,则Na、Cl的物质的量比为1:1,以此计算。
H2和Cl2的混合气体aL经光照反应后所得气体,恰好能与b mol的NaOH完全作用生成盐,若氢气和氯气恰好反应,生成的盐是NaCl,若氯气过量生成的盐为NaCl和NaClO的混合物,只有这两种情况,由于Na、Cl的物质的量比为1:1,则n(C12)=0.5bmol,其标况下体积为0.5bmol×22.4L/mol=11.2bL,利用极端假设法分析,若aL气体全部是氯气时,b=a/11.2,若aL气体全部是氢气,b=0。由于aL气体是氢气和氯气的混合气体,所以0<b<a/11.2,因此a与b的关系不可能为D,故答案选D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】相同温度下,体积均为0.25 L 的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.6kJ/mol.实验测得起始、平衡时的有关数据如表:
2NH3(g) ΔH=-92.6kJ/mol.实验测得起始、平衡时的有关数据如表:
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是( )
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数相等
C.容器②中达平衡时放出的热量Q=23.15kJ
D.若容器①体积为0.5L,则平衡时放出的热量小于23.15kJ