题目内容
【题目】自然界中存在大量的元素,如钠、镁、铝、铁、铜、砷、锌、镍等在生活中有着广泛的应用。
(1)请写出Fe的基态原子核外电子排布式________,砷属于________区元素。
(2)金属A的原子只有3个电子层,其第一至第四电离能如下:
电离能 |
|
|
|
|
A | 932 | 1821 | 15390 | 21771 |
则A原子的价电子排布式为___________________________。
(3)锌化铜是一种金属互化物,其化学式有多种形式,如![]() ,
,![]() ,
,![]() 等。其中所含元素铜的第二电离能________(填“大于”“小于”或“等于”)锌的第二电离能。
等。其中所含元素铜的第二电离能________(填“大于”“小于”或“等于”)锌的第二电离能。
(4)用锌还原![]() 的盐酸溶液,经后续处理可制得绿色的晶体
的盐酸溶液,经后续处理可制得绿色的晶体![]() 。该晶体所含元素中,电负性最大的元素是________,与Ti形成配位键的配体是________,
。该晶体所含元素中,电负性最大的元素是________,与Ti形成配位键的配体是________,![]() 该配合物中含有
该配合物中含有![]() 键的数目为________。
键的数目为________。
(5)![]() 能形成多种配离子,如
能形成多种配离子,如![]() ,
,![]() 等。
等。![]() 的空间构型为:________;与
的空间构型为:________;与![]() 互为等电子体的分子有:___________________(填分子式)。
互为等电子体的分子有:___________________(填分子式)。
(6)铜的化合物种类很多,如图是氯化亚铜的晶胞结构(黑色球表示![]() ,白色球表示
,白色球表示![]() ),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ=________
),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ=________![]() (用
(用![]() 表示阿伏加德罗常数)
表示阿伏加德罗常数)

【答案】![]() 或
或![]() p
p ![]() 大于 O
大于 O ![]() 、
、![]()
![]() 或
或![]() 三角锥形
三角锥形 ![]() 或
或![]()
![]()
【解析】
根据核外电子排布规律,写出铁基态原子核外电子排布式,根据As在元素周期表的位置写出分区。根据电离能的突变,找出原子的价电子数,写出价电子排布式。从原子的结构分析铜的第二电离能大于锌的第二电离能。利用原子的非金属性的大小比较出电负性的大小,根据配位键的定义和结构,找出![]() 键的数目。根据价层电子对互斥理论判断分子的立体构型,根据同族替换或等量代换找出等电子体。根据晶胞结构分析化学式并进行计算。
键的数目。根据价层电子对互斥理论判断分子的立体构型,根据同族替换或等量代换找出等电子体。根据晶胞结构分析化学式并进行计算。
(1)铁是26号元素,根据核外电子排布规律,可知其基态原子核外电子排布式为:
![]() 或
或![]() ;砷原子的外围电子排布为4s24p3,故位于p区;
;砷原子的外围电子排布为4s24p3,故位于p区;
(2)从表中原子的第一至第四电离能可以看出,A的第二电离能小,第三电离能较大,说明易失去2个电子,则A的化合价为+2价,应为Mg元素,价电子排布式为![]() ;
;
(3)根据失去一个电子后的价电子排布式确定第二电离能的大小;![]() 的价电子排布式为
的价电子排布式为![]() ,处于全充满状态;而锌失去一个电子后的排布式为
,处于全充满状态;而锌失去一个电子后的排布式为![]() ,最外层处于半充满状态,故铜的第二电离能大于锌的第二电离能;
,最外层处于半充满状态,故铜的第二电离能大于锌的第二电离能;
(4)在晶体![]() 中含有Ti、Cl、H、O四种元素,元素的非金属性越强,电负性越大。由于元素的非金属性最强的元素的O元素,所以O的电负性最大;晶体
中含有Ti、Cl、H、O四种元素,元素的非金属性越强,电负性越大。由于元素的非金属性最强的元素的O元素,所以O的电负性最大;晶体![]() 中内界离子是
中内界离子是![]() ,中心离子是
,中心离子是![]() ,配位体是
,配位体是![]() 、
、![]() ;配位数是6;外界离子是
;配位数是6;外界离子是![]() ,配离子
,配离子![]() 中含有共价键、配位键,
中含有共价键、配位键,![]() 中含有6个配位键,也属于
中含有6个配位键,也属于![]() 键,水分子中含有2个
键,水分子中含有2个![]() 键,故
键,故![]()
![]() 中含有
中含有![]()
![]() 键,个数为18NA;
键,个数为18NA;
(5)![]() 分子中N原子是
分子中N原子是![]() 杂化,且具有一对孤对电子,则
杂化,且具有一对孤对电子,则![]() 的空间构型为三角锥形,与
的空间构型为三角锥形,与![]() 互为等电子体的分子有:
互为等电子体的分子有:![]() 或
或![]() ;
;
(6)一个晶胞中Cu原子数目为![]() ,Cl原子数目为4,则晶胞密度为:
,Cl原子数目为4,则晶胞密度为: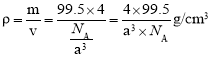 。
。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 | 实验 温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)通过实验A、B,可探究出___(填外部因素)的改变对化学反应速率的影响,其中V1=____、T1=____;通过实验___(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=____。
(2)若t1<8,则由此实验可以得出的结论是_____;忽略溶液体积的变化,利用实验B中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=___。
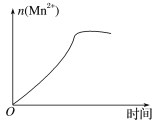
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对KMnO4与草酸之间的反应有某种特殊作用,则该作用是____,相应的粒子最可能是___(填粒子符号)。
【题目】相同温度下,体积均为0.25 L 的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.6kJ/mol.实验测得起始、平衡时的有关数据如表:
2NH3(g) ΔH=-92.6kJ/mol.实验测得起始、平衡时的有关数据如表:
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是( )
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数相等
C.容器②中达平衡时放出的热量Q=23.15kJ
D.若容器①体积为0.5L,则平衡时放出的热量小于23.15kJ