题目内容
【题目】某同学应用如图所示的方法研究物质的性质,其中气体a的主要成分是氯气,杂质是空气和水蒸气.
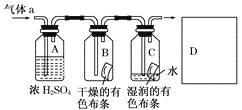
回答下列问题:
(1)该项研究(实验)的主要目的是__________________________________________.
(2)浓硫酸的作用是____________________________________________,与研究目的的直接相关的实验现象是________________________________________.
(3)从物质性质的方面来看,这样的实验设计存在着事故隐患,事故表现是___________,请在图中D框中以图的形式表明克服事故隐患的措施___________。
【答案】判断Cl2和HClO哪种物质漂白性 吸收气体a中的水蒸气 B内布条不褪色,C内的布条褪色 多余的Cl2污染空气 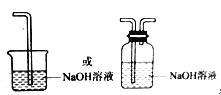
【解析】
(1)本实验的目的是探究氯气具有漂白性的条件下,干燥氯气不具有漂白性,氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白性;
(2)浓硫酸具有吸水性,干燥的氯气不具有漂白性,据此进行解答;
(3)氯气有毒,不能排放在空气中,在D中可以用氢氧化钠溶液吸收多余的氯气。
(1)由B、C可知起对比作用,则该实验的目的为比较Cl2和HClO谁有漂白性,
故答案为:探究氯气具有漂白性的条件;
(2)浓硫酸具有吸水性,其作用为吸收气体中的水蒸汽干燥氯气,干燥的氯气不具有漂白性,则与研究目的直接相关的实验现象是B中的布条不褪色,C中的布条褪色,
故答案为:干燥氯气;B中有色布条不退色,C中有色布条退色;
(3)氯气有毒,应进行尾气处理,不能随意排放到空气中,应加尾气处理装置,如图 ,
,
故答案为:氯气外逸,污染环境;

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案【题目】实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:

实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
试完成下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是____________________。
不能用铜丝搅拌棒代替环形玻璃棒的理由是_____________________。
(2)经数据处理,t2—t1=3.4 ℃。则该实验测得的中和热ΔH=________[盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:ΔH1__________ΔH(填“<”、“>”或“=”),理由是_______________。



