题目内容
1.A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族.(1)B在周期表中的位置第二周期ⅤA族;
(2)E元素形成的最高价氧化物对应的水化物的化学式为H2SO4;
(3)元素C、D、E形成的离子半径大小关系是S2->O2->Na+(用离子符号表示).
(4)用电子式表示化合物D2C的形成过程
 .
.C、D还可形成化合物D2C2,D2C2含有的化学键是离子键、非极性共价键(或离子键、共价键).
(5)由A、B、C三种元素形成的离子化合物的化学式为NH4NO3.
分析 A元素的原子核内只有1个质子,则A为H元素,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3,则B的最高化合价为+5价,位于周期表第ⅤA族,应为N元素,C元素原子的最外层电子数比次外层多4个,则原子核外电子排布为2、6,应为O元素,C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C,则D的化合价为+1价,应为Na元素,C、E主族,则E为S元素,根据原子的组成、性质结合周期律的递变规律解答该题.
解答 解:由以上分析可知A为H元素,B为N元素,C为O元素,D为Na元素,E为S元素,则
(1)B为N元素,原子核外有2个电子层,最外层电子数为5,则位于周期表第二周期ⅤA族,
故答案为:第二周期ⅤA族;
(2)E为S元素,对应的最高价氧化物的水化物有H2SO4,
故答案为:H2SO4;
(3)元素C、D、E形成的离子分别为O2-、Na+、S2-,S2-离子核外有3个电子层,离子半径最大,O2-与Na+离子核外电子排布相同,都有2个电子层,核电核数越大,半径越小,则半径O2->Na+,
故答案为:S2->O2->Na+;
(4)化合物D2C为Na2O,为离子化合物,用电子式表示的形成过程为 ,D2C2为Na2O2,为离子化合物,含有离子键和非极性共价键,
,D2C2为Na2O2,为离子化合物,含有离子键和非极性共价键,
故答案为: ;离子键、非极性共价键(或离子键、共价键);
;离子键、非极性共价键(或离子键、共价键);
(5)由A、B、C三种元素形成的离子化合物为NH4NO3,
故答案为:NH4NO3;
点评 本题考查元素位置结构性质的相互关系应用,题目难度中等,注意正确推断元素的种类为解答该题的关键,(5)为易错点,注意由非金属元素形成的离子化合物.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.化学与社会生活密切相关,下列说法正确的是( )
| A. | 臭氧、乙醇溶液均可用于消毒杀菌且原理完全相同 | |
| B. | 半导体材料和光纤制品都是以硅为基本原料生产的 | |
| C. | 煤的干馏和石油的分馏均属化学变化 | |
| D. | 亚硝酸盐、二氧化硫均可以用作食品的防腐剂 |
12.能正确表示下列反应的离子方程式是( )
| A. | 烧碱溶液中通入过量二氧化硫 2OH-+SO2═SO32-+H2O | |
| B. | 在亚硫酸氢铵稀溶液中加入足量的氢氧化钠稀溶液 NH4++H++2OH-═NH3•H2O+H2O | |
| C. | 硫酸铁的酸性溶液中通入足量硫化氢 2Fe3++H2S═2Fe2++S↓+2H+ | |
| D. | 铜与浓硝酸:Cu+2H++2NO3-═Cu2++2NO2↑+H2O |
9.简单原子的原子结构可用如图的表示方法来形象表示,其中“黑球”表示质子或电子,“白球”表示中子.则下列有关①、②、③的叙述中正确的是( )


| A. | ①、②、③互为同位素 | B. | ①、②、③互为同素异形体 | ||
| C. | ①、②、③是三种化学性质不同的核素 | D. | ①、②、③质量数相同 |
6.一定温度下,反应:N2(g)+3H2(g)?2NH3(g),达到化学平衡状态的标志是( )
| A. | c(N2)﹕c(H2)﹕c(NH3)=1﹕3﹕2 | |
| B. | N2,H2和NH3的质量分数不再改变 | |
| C. | N2与H2的物质的量之和是NH3的物质的量的2倍 | |
| D. | 单位时间内每增加1mol N2,同时增加3mol H2 |
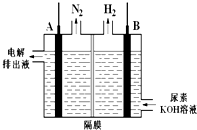
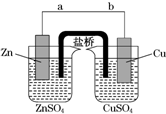 某学生利用如图实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64).按照实验步骤依次回答下列问题:
某学生利用如图实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64).按照实验步骤依次回答下列问题: