题目内容
16.美国斯坦福大学研究人员最近发明一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电.海水中的“水”电池总反应可表示为:5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl(1)写出负极电极反应式Ag+Cl--e-=AgCl↓.
(2)当生1mol Na2Mn5O10时,转移电子的数目是1.204×1024.
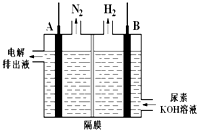
用上述电池电解尿素[CO(NH2)2]的碱性溶液制合成氨的装置如图(隔膜仅阻止气体通过,阴、阳极均为惰性电极).
(3)写出A电极的名称阳极.
(4)写出电解时阳极的电极反应式CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.
(5)已知电解排出液中$\frac{n(O{H}^{-})}{n(C{O}_{3}^{2-})}$=1,则起始时进入电解池中的原料配比$\frac{n(KOH)}{n[CO(N{H}_{2})_{2}]}$是3:1.
分析 (1)负极上失电子发生氧化反应;
(2)根据Na2Mn5O10和转移电子之间的关系式计算;
(3)由图可知,CO(NH2)2在阳极放电生成N2;
(4)据图可知,CO(NH2)2得电子生成氮气,C元素价态不变,生成碳酸根离子,据此分析;
(5)电解时总的化学方程式为:CO(NH2)2+2OH-$\frac{\underline{\;通电\;}}{\;}$CO32-+N2↑+3H2↑,电解排出液中$\frac{n(O{H}^{-})}{n(C{O}_{3}^{2-})}$=1,可以推知起始时进入电解池中的原料配比$\frac{n(KOH)}{n[CO(N{H}_{2})_{2}]}$.
解答 解:(1)根据电池总反应:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,可判断出Ag应为原电池的负极,负极发生反应的电极方程式为:Ag+Cl--e-=AgCl,
故答案为:Ag+Cl--e-=AgCl↓;
(2)根据方程式中5MnO2生成1Na2Mn5O10,化合价共降低了2价,所以每生成1molNa2Mn5O10转移2mol电子,转移电子数目为1.204×1024,故答案为:1.204×1024;(3)CO(NH2)2在A极放电生成N2,反应方程式为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O,故答案为:阳极;
(4)阳极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O,故答案为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O;
(5)电解时总的化学方程式为:CO(NH2)2+2OH-$\frac{\underline{\;通电\;}}{\;}$CO32-+N2↑+3H2↑,参加反应的OH-与生成的CO32-的物质的量之比为2:1,电解排出液中$\frac{n(O{H}^{-})}{n(C{O}_{3}^{2-})}$=1时,则起始时进入电解池中的原料配比$\frac{n(KOH)}{n[CO(N{H}_{2})_{2}]}$是3:1,故答案为:3:1.
点评 本题考查了原电池和电解原理,明确元素化合价变化是解本题关键,根据元素化合价变化与阴阳极的关系来分析解答,难度中等.

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案| A. | 用食醋除去暖瓶内的水垢 | |
| B. | 鸡蛋白溶液中加入硫酸铵饱和溶液后析出白色沉淀 | |
| C. | 淀粉溶液中加碘水变蓝 | |
| D. | 棉花织品和羊毛织品:分别灼烧闻气味 |
| A. | 把一段打磨过的镁带放入少量冷水中 | |
| B. | 把 Cl2通入FeCl2溶液中 | |
| C. | 把绿豆大的钾投入水中 | |
| D. | 氢氟酸滴到玻璃上 |
| A. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA | |
| B. | 常温常压下,44 g C3H8中含有的碳碳单键数为3 NA | |
| C. | 6.4 g铜粉与足量硫粉充分反应,失去的电子数为0.2 NA | |
| D. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3 NA |
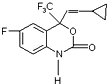 M是一种治疗艾滋病的新药(结构简式见图),已知 M的分子中-NH-COO-基团(除H外)与苯环在同一个平面内,关于M的以下说法正确的是( )
M是一种治疗艾滋病的新药(结构简式见图),已知 M的分子中-NH-COO-基团(除H外)与苯环在同一个平面内,关于M的以下说法正确的是( )| A. | 该物质易溶于水 | |
| B. | M能发生缩聚反应 | |
| C. | M分子内至少有15个原子在同一个平面上 | |
| D. | M的分子式为C13H22O2NF4 |
 ; O22+中σ键数目和π键数目之比为1:2.
; O22+中σ键数目和π键数目之比为1:2.
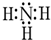 ,分子间存在氢键.
,分子间存在氢键. .
.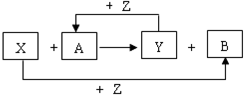 X、Y、Z为常见的三种单质,Z是绿色植物光合作用的产物之一,A、B为常见化合物.它们在一定条件下可发生如图所示的反应(均是在非溶液中进行的反应):
X、Y、Z为常见的三种单质,Z是绿色植物光合作用的产物之一,A、B为常见化合物.它们在一定条件下可发生如图所示的反应(均是在非溶液中进行的反应): ;
; 或
或 ;
;