题目内容
【题目】近几年我国大面积发生雾霾天气,2.5微米以下的细颗粒物(PM2.5)是导致雾霾天气的“罪魁祸首”。空气中的CO、SO2、NOx等污染气体会通过大气化学反应生成PM2.5颗粒物。
(1)已知:2C(s)+O2(g)![]() 2CO(g) ΔH1= -221.0 kJ/mol
2CO(g) ΔH1= -221.0 kJ/mol
N2(g)+O2(g)![]() 2NO (g) ΔH2= +180.5 kJ/mol
2NO (g) ΔH2= +180.5 kJ/mol
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH3= -746.0 kJ/mol
2CO2(g)+N2(g) ΔH3= -746.0 kJ/mol
用焦炭还原NO生成无污染气体的热化学方程式为_________________________________。
(2)已知由CO生成CO2的化学方程式为CO+O2![]() CO2+O 。其正反应速率为v正=k正·c(CO) ·c(O2),逆反应速率为v逆=k逆·c(CO2) ·c(O),k正、k逆为速率常数。在2500 K下,k正=1.21×105 L·s-1·mol-1,k逆=3.02×105 L·s-1·mol-1。则该温度下上述反应的平衡常数K值为_________________________(保留小数点后一位小数)。
CO2+O 。其正反应速率为v正=k正·c(CO) ·c(O2),逆反应速率为v逆=k逆·c(CO2) ·c(O),k正、k逆为速率常数。在2500 K下,k正=1.21×105 L·s-1·mol-1,k逆=3.02×105 L·s-1·mol-1。则该温度下上述反应的平衡常数K值为_________________________(保留小数点后一位小数)。
(3)CO2可用来生产燃料甲醇。CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
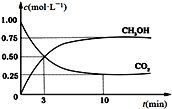
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________________ mol·(L·min) -1。
②氢气的转化率=________________________。
③下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是_____________________。
A.升高温度 B.充入0.5 mol CO2 和1.5 mol H2
C.充入He(g),使体系压强增大 D.将H2O(g)从体系中分离出去
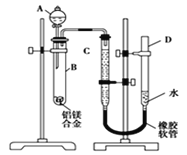
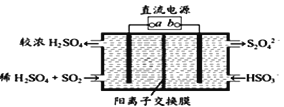
(4)利用如图所示电解装置(电极均为惰性电极)可吸收SO2,并用阴极室排出的溶液吸收NO2 。与电源b极连接的电极的电极反应式为____________________________________。
(5)NO2在一定条件下可转化为NH4NO3和NH4NO2。相同温度下,等浓度NH4NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH4+)较小,分析可能的原因________________________。
【答案】2NO(g)+ C (s)![]() CO2(g)+ N2(g) ΔH=-573.75kJ/mol 0.4 0.225 75% BD HSO3—+2e—+2H+ = S2O42—+2H2O NO2—水解对NH4+的水解起促进作用(或NO2—与NH4+氧化还原产生氮气)
CO2(g)+ N2(g) ΔH=-573.75kJ/mol 0.4 0.225 75% BD HSO3—+2e—+2H+ = S2O42—+2H2O NO2—水解对NH4+的水解起促进作用(或NO2—与NH4+氧化还原产生氮气)
【解析】
(1)①2C(s)+O2(g)2CO(g)△H1=-221.0kJ/mol,②N2(g)+O2(g)2NO (g)△H2=+180.5kJ/mol,③2NO(g)+2CO(g)2CO2(g)+N2(g)△H3=-746.0kJ/mol,根据盖斯定律,(①+③-②)×![]() 得:2NO(g)+C(s)CO2(g)+N2(g) △H=-573.75kJ/mol,故答案为:2NO(g)+C (s)CO2(g)+N2(g) △H=-573.75kJ/mol;
得:2NO(g)+C(s)CO2(g)+N2(g) △H=-573.75kJ/mol,故答案为:2NO(g)+C (s)CO2(g)+N2(g) △H=-573.75kJ/mol;
(2)由CO生成CO2的化学方程式为CO+O2CO2+O.其正反应速率为v正=k正c(CO)c(O2),逆反应速率为v逆=k逆c(CO2)c(O),平衡常数K=![]() =
=![]() =
=![]() =0.4,故答案为:0.4;
=0.4,故答案为:0.4;
(3)①根据图像分析可知甲醇变化浓度为0.75mol/L,反应速率v(CH3OH)= ![]() =0.075mol/(Lmin),速率之比等于化学方程式计量数之比,v(H2)=3v(CH3OH) =0.225mol/(Lmin),故答案为:0.225;
=0.075mol/(Lmin),速率之比等于化学方程式计量数之比,v(H2)=3v(CH3OH) =0.225mol/(Lmin),故答案为:0.225;
②氢气的转化率= ![]() ×100%=75%,故答案为:75%;
×100%=75%,故答案为:75%;
③A.因正反应放热,升高温度平衡向逆反应方向移动,则比值减小,故A错误;B.再充入充入0.5mol CO2和1.5mol H2,增大反应物浓度,平衡向正反应方向移动,则比值增大,故B正确;C.充入He(g),使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,比值不变,故C错误;D.将H2O(g)从体系中分离,平衡向正反应方法移动,比值增大,故D正确;故答案为:BD;
(4)依据图示可知,阴极上HSO3-得电子生成S2O42-,阴极区发生反应2HSO3-+2H++2e-=S2O42-+2H2O;故答案为:2HSO3-+2H++2e-=S2O42-+2H2O;
(5)相同温度下等浓度的NH4NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH4+)较小,是因为NO2-是弱酸阴离子水解显碱性,铵根离子水解显酸性,二者水解相互促进,故答案为:NO2-水解对NH4+的水解起促进作用。

 阅读快车系列答案
阅读快车系列答案