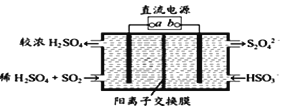
题目内容
【题目】下列化学用语正确的是
A. 雕刻玻璃的试剂主要成分的电子式为:![]()
B. 新制氯水中含氧酸的结构式:H—Cl—O
C. S2-的结构示意图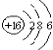
D. 标准状况下密度为1.25g/L的气态烃的球棍模型:![]()
【答案】D
【解析】
A、HF是共价化合物;
B、次氯酸结构式中O分别与H和Cl相连;
C、S2-最外层8个电子;
D、乙烯碳与碳之间形成双键。
A、HF是共价化合物,雕刻玻璃的试剂主要成分的电子式为:![]() ,故A错误;
,故A错误;
B、次氯酸结构式中O分别与H和Cl相连,新制氯水中含氧酸的结构式:H—O—Cl,故B错误;
C、S2-最外层8个电子,结构示意图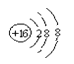 ,故C错误;
,故C错误;
D、标准状况下密度为1.25g/L的气态烃为乙烯,乙烯碳与碳之间形成双键,球棍模型:![]() ,故D正确。
,故D正确。
故选D。

练习册系列答案
相关题目