题目内容
【题目】I. 三氯化铁对铜(Cu)说:尽管你不活泼,但我还是会包溶你。
(1)写出FeCl3溶液包溶铜板的离子方程式:______________________。
(2)若将(1)中的反应设计成原电池,写出电极反应式。
正极反应: _________________________________________;
负极反应:__________________________________________。
II. 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol/L的H2SO4溶液中,乙同学将电极放入6 mol/L的NaOH溶液中,如图所示。
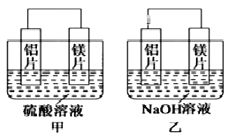
(1)甲中SO42-移向____(填“铝片”或“镁片”),写出甲中正极的电极反应式__________。
(2)乙中负极为______(填“铝片”或“镁片”)总反应的离子方程式:__________________。
【答案】2Fe3++Cu=2Fe2++Cu2+ Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+) Cu-2e-=Cu2+ 镁片 2H++2e-=H2↑ 铝片 2Al+2H2O+2OH-=2AlO2-+3H2↑
【解析】
I. (1) FeCl3溶液腐蚀印刷电路铜板,生成氯化铜、氯化亚铁;
(2)原电池的构成条件:自发的氧化还原反应,在原电池的负极上发生失电子的氧化反应,正极上是还原反应,据氧化还原反应确定电解质溶液;
II.甲同学依据的化学反应原理是Mg+H2SO4=MgSO4+H2↑,乙同学依据的化学反应原理是2Al+2NaOH+2H2O=2NaAlO2+3H2↑,由于Al显两性,与酸碱都能发生反应。
(1)甲中镁易失电子作负极、Al作正极,负极上镁发生氧化反应、正极上氢离子发生还原反应,溶液中离子移动方向可根据同种电荷相互排斥,异种电荷相互吸引的原则分析;
(2)乙池中铝易失电子作负极、镁作正极。
I.(1) FeCl3溶液包溶铜板的离子方程式为:2Fe3++Cu=2Fe2++Cu2+;
(2)原电池的构成条件:自发的氧化还原反应,据此确定电解质溶液,在原电池的石墨为正极,该电极上发生的电子的还原反应,即2Fe3++Cu═2Fe2++Cu2+;负极上发生失电子的氧化反应,该反应为Cu-2e-=Cu2+,电解质是FeCl3溶液;
II.(1)甲用Mg与H2SO4发生反应,总反应方程式为Mg+2H+=Mg2++ H2↑,Mg失去电子,发生氧化反应,作负极,电极反应式为Mg-2e-=Mg2+,负极附近溶液中阳离子浓度大,所以溶液中带负电荷的SO42-向负极镁片移动;在正极上,溶液中的H+获得电子,变为H2逸出,正极的电极反应式为2H++2e-=H2↑;
(2)在乙中,由于Mg不能与NaOH溶液发生反应,Al能够发生反应,所以Al为负极,失去电子,发生氧化反应,Mg为正极,正极上发生还原反应,总反应的离子方程式2Al+2H2O+2OH-=2AlO2-+3H2↑。

 互动英语系列答案
互动英语系列答案