题目内容
(8分)已知A、B、C、D、E是短周期中的5元素,它们的原子序数依次增大。A是原子半径最小的元素,C、D在元素周期表中处于相邻的位置,B原子的最外层电子数是内层电子数的2倍。E元素与D元素同主族;E的单质为黄色晶体,易溶于二硫化碳。回答下列问题:
(1)元素D在周期表中的位置是 。
(2)画出E的阴离子的结构示意图: 。
(3)写出一种由A、B、C、D四种元素组成的离子化合物的化学式: 。
写出一种由A、C、D三种元素组成的共价化合物的化学式: 。
(4)将9 g B单质在足量的D单质中燃烧,所得气体通入1 L 1 mol·L-1NaOH溶液中,
完全吸收后,溶液中大量存在的阴离子是 。
(8分) (1)第2周期ⅥA族 (1分)
(2)  (1分)
(1分)
(3) NH4HCO3或(NH4)2CO3(2分)
HNO3或HNO2(2分)
(4) CO32-和 HCO3-(2分,缺一项不得分)
解析试题分析:A是原子半径最小的元素,所以A是H元素;,B原子的最外层电子数是内层电子数的2倍,所以B最外层电子是4个,有2层电子,B是C元素; E的单质为黄色晶体,易溶于二硫化碳,E是S元素;E元素与D元素同主族,则D是O元素;C、D在元素周期表中处于相邻的位置,则C是N元素。根据以上分析得:
(1) 元素D在周期表中的位置是第2周期ⅥA族;
(2)E的阴离子即S2-的结构示意图:
(3)由A、B、C、D四种元素组成的离子化合物是NH4HCO3或(NH4)2CO3;由A、C、D三种元素组成的共价化合物是HNO3或HNO2;
(4)9 g C单质在足量的氧气中燃烧,生成0.75mol的CO2,与1mol的NaOH反应生成的产物可通过计算判断。设产物中NaHCO3、Na2CO3的物质的量分别是x、y,根据元素守恒得x+2y=1mol,x+y=0.75mol,解得x=0.5mol,y=0.25mol,所以完全吸收后,溶液中大量存在的阴离子是CO32-和 HCO3-。
考点:考查元素推断,元素位置的判断,离子结构示意图,化学式的书写,二氧化碳与氢氧化钠的反应产物的判断

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 零 |
| 2 | | | | ① | ② | ③ | | |
| 3 | ④ | | | ⑤ | | | ⑥ | ⑦ |
(1)在这些元素中,化学性质最不活泼的是: (填元素符号)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 ,碱性最强的化合物的电子
式是: 。
(3)①、②、③、⑤四种元素中在常温常压下的液态或气态氢化物的稳定性由大到小的顺序是 。(填氢化物的分子式)
(4)①与③形成的三原子分子属于 (填电解质或非电解质),它的结构式是___________,
其晶体类型为____________ 。⑥与④形成化合物的电子式是 ,其晶体类型为 _。
(5)④元素某氧化物与①元素某氧化物反应生成单质③的化学方程式是__________________________;
若有标况下22.4L单质B生成,电子转移的数目为 。
(15分)(1)碳、氮、氧的第一电离能大小顺序为 ,氧原子电子排布式为 。
(2)氨分子氮原子杂化类型 ,氨水中四种氢键哪一种是主要的 ,规律是什么? 。画出氢氟酸溶液中最主要氢键 。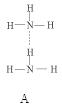
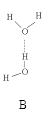
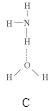
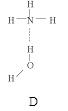
(3)DNA中四种碱基间通过氢键可能的配对方式,用虚线把氢键表示出来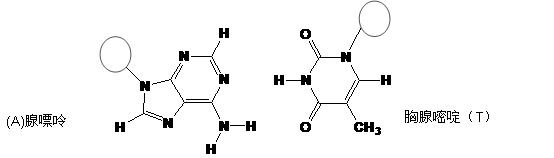

(4)试分析富马酸的K2大于其顺式异构体马来酸K2的原因。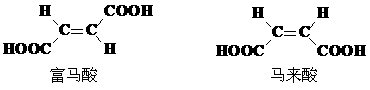
(5)下表是三种火箭推进剂的沸点,为什么火箭推进剂选择氮元素? 。
| 物质 | H2 | N2H4 | H2NN(CH3)2 |
| 沸点/℃ | -252.8 | 113.5 | ~116 |
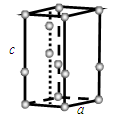
回答下列问题:
①计算晶胞中含有几个水分子。 ②计算冰的密度。
(12分)【化学一物质结构与性质】
根据物质结构与性质的关系,请回答下列问题:
(1)基态铬(Cr)原子的价电子排布式是________,这样排布使整个体系能量最低,原因是________。
(2)氨水中存在多种形式的氢键,其中与“氨极易溶于水”这种性质相关的氢键可表示为:_________。解释NH3分子中键角大于H2O中的键角的原因是_________ 。
(3)下列各项的比较中正确的是_________。
| A.第一电离能:Mg>Al | B.电负性:P>Ge |
| C.稳定性:AsH3>H2S | D.金属性: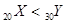 |
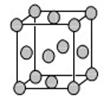
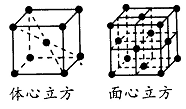
结构如图所示,体心立方晶胞和面心立方晶胞中实际含有的
Fe原子个数之比为_________。
近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在470℃、80MPa下合成出金刚石,具有深远意义。下列说法不正确的是( )
| A.由二氧化碳合成金刚石是化学变化 | B.金刚石是碳的一种同位素 |
| C.钠被氧化最终生成碳酸钠 | D.金刚石中只含有非极性共价键 |
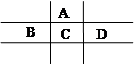
 的空间构型是 ,其中D原子的杂化轨道类型是 。
的空间构型是 ,其中D原子的杂化轨道类型是 。