��Ŀ����
��12�֣�����ѧһ���ʽṹ�����ʡ�
�������ʽṹ�����ʵĹ�ϵ����ش��������⣺
��1����̬��(Cr)ԭ�ӵļ۵����Ų�ʽ��________�������Ų�ʹ������ϵ������ͣ�ԭ����________��
��2����ˮ�д��ڶ�����ʽ������������롰����������ˮ������������ص�����ɱ�ʾΪ��_________������NH3�����м��Ǵ���H2O�еļ��ǵ�ԭ����_________ ��
��3�����и���ıȽ�����ȷ����_________��
| A����һ�����ܣ�Mg>Al | B���縺�ԣ�P>Ge |
| C���ȶ��ԣ�AsH3>H2S | D�������ԣ�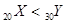 |
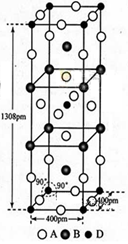
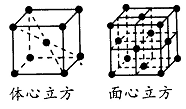
�ṹ��ͼ��ʾ������������������������������ʵ�ʺ��е�
Feԭ�Ӹ���֮��Ϊ_________��
��12�֣�
��1��3d54s1��2�֣� 3d��4s����ϵĵ��Ӿ�Ϊ�����״̬��2�֣�
��2��O��H��N N��H��O��2�֣� NH3������Nԭ�Ӳ���sp3�ӻ���Nԭ�ӻ���һ�Թ¶Ե��ӣ���H2O������Oԭ�Ӳ���sp3�ӻ���Oԭ�������Թ¶Ե��ӣ��Գɼ����ӵ��ų����ø�ǿ��ʹ���Ǹ�С����2�֣�
��3��AB��2�֣�
��4��1:2��2�֣�
���������������1��CrΪ24��Ԫ�أ��۵����Ų�ʽ��3d54s1�����ݺ��ع�������Ų��ĵ���Ϊȫ����������ʱ��״̬�ȶ�����ϵ�������ͣ�Cr��̬ԭ��3d��4s����ϵĵ��Ӿ�Ϊ�����״̬������������ϵ������͡�
��2������������ˮ��NH3������H2O���Ӽ��γ���������ɱ�ʾΪ��O��H��N N��H��O��Nԭ���������5�����ӣ���3��Hԭ���γ�N��H����Nԭ�ӻ���һ�Թ¶Ե��ӣ���H2O�����У�Oԭ����2��Hԭ���γ�O��H���������Թ¶Ե��ӣ��Գɼ����ӵ��ų����ø�ǿ��ʹ���Ǹ�С��
��3��A��Mgԭ��2s����Ų�2�����ӣ�Ϊȫ����״̬�����Ե�һ�����ܣ�Mg>Al����ȷ��B������Ԫ�����ڱ����縺��P > Si��Si > Ge����P > Ge����ȷ��C���ȶ��ԣ� H2S > PH3 >AsH3������D��X������Ϊ20��ΪCa�� Y������Ϊ30��ΪZn��������Ca > Zn������
��4�������и����������������Fe��8��1/8+1=2����������������Fe��8��1/8+6��1/2=4����������������������������������ʵ�ʺ��е�Feԭ�Ӹ���֮��Ϊ��1:2��
���㣺���⿼������Ų��������Ԫ�������ɡ������ļ��㡣

X��Y��Z��W��Ԫ�����ڱ�ǰ�����ڳ���������Ԫ�أ�ԭ��������������X�ĵ��ʼ��ЦҼ��V�Цм�����X�ĵ�һ�����ܱ�������Ԫ�ض���Y�ĵ縺�Ա�X��С�����̬ԭ��������p�����Ǹò�s���ӵ�������Z��ǰ36��Ԫ����ԭ�Ӱ뾶��������Ԫ�أ�W��һ�ֺ��ص���������56����������30��
(1) Yλ��Ԫ�����ڱ���_______���ڵ�_______�壬W2+�ĺ�������Ų�ʽ��______��
(2) X��������XO2��H2O�Ƚϣ��۵�ϸߵ���_______ (�ѧʽ)��Z���⻯������ ���壬Z2O2�Ļ�ѧ��������_______(���ţ�
| A�����Ӽ� | B�����Թ��ۼ� | C���Ǽ��Թ��ۼ� | D�������� |
(4)��250C��101kPa�£�W�ĵ�����������ȼ�պ�ָ���ԭ�¶Ⱥ�ѹǿ��ƽ��ÿת��1mol���ӷų�QkJ����������W����ȼ�յ��Ȼ�ѧ����ʽ��_______��
�±���Ԫ�����ڱ���һ���֡��������е���ĸ�ֱ����һ�ֻ�ѧԪ�ء�
| | | | |||||||||||||||
| | | | | | a | | b | | |||||||||
| | | c | | | d | e | | ||||||||||
| | | | | | | | | f | | g | | | | | | | |
��1��a���⻯��ķ��ӹ���Ϊ ������ԭ�ӵ��ӻ���ʽΪ ��d�����������ķ��ӹ���Ϊ ������ԭ�ӵ��ӻ���ʽΪ ���÷����� ������ԡ��Ǽ��ԡ������ӡ�
��2��b��d��e����Ԫ�ص��⻯���еķе���ߵ��� ��ԭ���ǣ� ��
��3����g����ˮ�������ܽ���ˮ�У���Һ����ɫ������Ϊ������һ�ֳ���ɫ��������ӣ�д����������ӵĽṹ��ʽ(���뽫��λ����ʾ����) ��
��4��f(NH3)5BrSO4���γ���������� ����֪f 3�� ����λ����6��Ϊȷ��f�������Ľṹ���ֶ�����������������ʵ�飺�ڵ�һ����������Һ�м�BaCl2��Һʱ��������ɫ�������ڵڶ����������Һ�м���BaCl2��Һʱ�������������ڶ��������Ļ�ѧʽΪ ���������������� �� ��
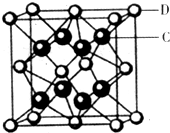
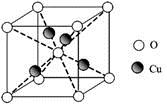
��5��c���ʾ�����ԭ�ӵĶѻ���ʽ����ͼ����ʾ���侧����������ͼ����ʾ��ԭ��֮���λ�ù�ϵ��ƽ��ͼ����ͼ����ʾ��
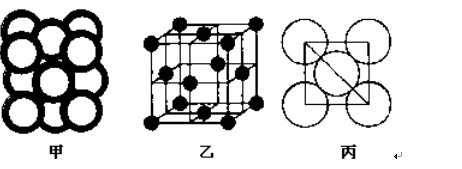
c���ʾ�����ԭ�ӵ���λ��Ϊ ������֪c��ԭ�Ӱ뾶Ϊr��NA���������ӵ�������c�����ԭ������ΪM���þ�����ܶ�Ϊ ������ĸ��ʾ����
�� 13�֣�����ı�����Ԫ�����ڱ���һ���֣����е���ĸ��Ӧ��ͬ��Ԫ�ء�
| A | | | |||||||||||||||
| | | | | M | Q | R | | | |||||||||
| | | E | | | | D | | ||||||||||
| | | | G | | | | J | | | | | | | | | | |
��1��G��J�γɵĺϽ���һ��������ϣ��侧��ṹ���Ȼ����ͬ���úϽ���ÿ��Gԭ����Χ��������ҵȾ��Jԭ���� �����þ������� ����
A .���Ӿ��� B . ԭ�Ӿ��� C . ���Ӿ��� D. ��������
��2��M3R2��һ��ֱ���ͷ���R=M=M=M=R���÷�����һ�� ���ӣ���Ի�Ǽ��ԣ���
��3����д��D-�ĵ����Ų�ʽ�� ��
��4��M2A2Ҳ��ֱ���ͷ��ӣ�1�������к��� ���Ҽ���
��5��������E2D6�����и�ԭ�Ӿ��ﵽ�˰˵����ȶ��ṹ���뻭����ṹʽ������Ԫ�ط��ű�ʾ��
���ڻ�ѧ���ĸ�����������ȷ���ǣ� ��
| A�������ӻ������ֻ�������Ӽ� | B���Ǽ��Լ�ֻ������˫ԭ�ӵĵ��ʷ����� |
| C�����ۻ������һ�����������Ӽ� | D����ͬԪ����ɵĶ�ԭ�ӷ����ֻ���ڼ��Լ� |