题目内容
下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 零 |
| 2 | | | | ① | ② | ③ | | |
| 3 | ④ | | | ⑤ | | | ⑥ | ⑦ |
(1)在这些元素中,化学性质最不活泼的是: (填元素符号)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 ,碱性最强的化合物的电子
式是: 。
(3)①、②、③、⑤四种元素中在常温常压下的液态或气态氢化物的稳定性由大到小的顺序是 。(填氢化物的分子式)
(4)①与③形成的三原子分子属于 (填电解质或非电解质),它的结构式是___________,
其晶体类型为____________ 。⑥与④形成化合物的电子式是 ,其晶体类型为 _。
(5)④元素某氧化物与①元素某氧化物反应生成单质③的化学方程式是__________________________;
若有标况下22.4L单质B生成,电子转移的数目为 。
(1)Ar(1分) (2)HClO4(1分);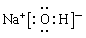 (1分)
(1分)
(3)H2O>NH3>CH4>SiH4(2分) (4)非电解质(1分); O=C=O(1分);分子晶体(1分)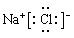 (1分);离子晶体(1分)
(1分);离子晶体(1分)
(5)2CO2+2Na2O2=2Na2CO3+O2(2分);2NA(2分)
解析试题分析:根据元素①~⑨在表中的位置可知,它们分别是C、N、O、Na、Si、Cl、Ar。
(1)稀有气体的化学性质最不活泼,因此在这些元素中,化学性质最不活泼的是Ar。
(2)非金属性或金属性越强,则最高价氧化物对应水化物的酸性或碱性越强,因此酸性最强的化合物是高氯酸,其化学式是HClO4;碱性最强的化合物是氢氧化钠,含有离子键和共价键的离子化合物,其电子式是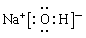 。
。
(3)非金属性越强,相应氢化物的稳定性越强,非金属性是O>N>C>Si,所以氢化物的稳定性是H2O>NH3>CH4>SiH4。
(4)碳元素与氧元素形成的三原子分子是CO2,由于CO2不能自身电离,所以是非电解质。分子中含有碳氧双键,因此其结构式为O=C=O,形成的晶体是分子晶体;Na和Cl都是活泼的金属与非金属,二者形成的化学键是离子键,形成的化合物是离子晶体,其电子式为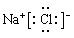 。
。
(5)碳元素与钠元素的氧化物能反应生成氧气的应该是CO2与过氧化钠,反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2;标准状况下22.4L氧气的物质的量是1mol,由于在反应中过氧化钠既是氧化剂,也是还原剂,氧元素的化合价才-1价升高到0价,因此反应中转移电子的个数2NA。
考点:考查元素周期表的结构以及元素周期律的应用

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案X、Y、Z、W是元素周期表中前30号元素,且原子序数依次增大。其相关信息如下表:
| 元素 | 相关信息 |
| X | X原子基态时最外层电子数是其内层电子总数的2倍 |
| Y | Y的基态原子最外层电子排布式为nsnnpn+2 |
| Z | Z元素的最高正价与负价代数和为6 |
| W | W基态原子未成对电子数是前30号元素中最多的 |
(1)W位于元素周期表第 周期第 族,其基态原子最外层有 个电子。
(2)X的第一电离能比Y的 (填“大”或“小”),1mol X22-中含有的
 键数目为 。
键数目为 。(3)X和Y的气态氢化物中,较稳定的是 (写化学式),Y的同族元素(包括Y)的最简单氢化物中沸点最低的是 。
(4)写出KZY3与HZ浓溶液反应制取Z2的化学方程式,并标出电子转移的方向和数目 。
(5)已知:X(s)+Y2(g)=XY2(g) ΔH 1= -393.5 kJ?mol-1
XY(g) +1/2Y2(g)=XY2(g) ΔH 2= -282.9 kJ?mol-1
则X(s)与Y2(g)反应生成XY(g)的热化学反应方程式为 。
下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,
回答下列问题:
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | ⑨ | ⑥ | ⑦ | | | ⑧ | |
(1)由①、②两种元素组成的相对分子质量为28的有机物的空间构型是 ,
该物质与溴水发生加成反应的化学方程式是 。
(2)用电子式表示④的简单氢化物的形成过程如下: ;
(3) 请设计实验比较元素⑥与⑨金属性的相对强弱: _;
(4) 用①元素的单质与④元素的单质可以制成电池,电池中装有KOH浓溶液,将多孔的惰性电极甲和乙浸入KOH溶液中,在甲极通入①的单质,乙极通入④的单质,则甲极的电极反应式为: 。
(5)由表中①、③、④、⑥、⑧元素形成的常见物质X、Y、Z、M、N可发生以下反应:
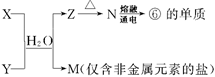
X溶液与Y溶液反应的离子方程式为 ,工业上常用单质⑥冶炼难熔的金属,写出氧化铁和单质⑥在高温下反应的化学方程式 。
A、B、C、D、E为前四周期中原子序数依次增大的元素,相关的信息如下:
| 元素 | 相关信息 |
| A | A元素原子核外只有三个能级,且每个能级上含有相等的电子数 |
| B | 是空气中含量最丰富的元素 |
| C | 短周期中,单质C的金属性最强 |
| D | 基态原子第三能层上有7种运动状态不同的电子 |
| E | 一种核素的质量数为63,中子数为34 |
请用对应的元素符号回答下列问题:
(1)A与氢可形成一种的分子式为A2H4化合物,该分子中存在σ键与π键数目比为 。
(2)H—A、H—B两种共价键中,键能较大的是 ;H—A、H—D两种共价键中,键的极性较强的是
(3)E位于周期表中的位置是 ,单质E与B的最高价氧化物的水化物的稀溶液反应的离子方程式为 。
(4)根据下列能量变化示意图,请写出BO和AO2反应的热化学方程式 。
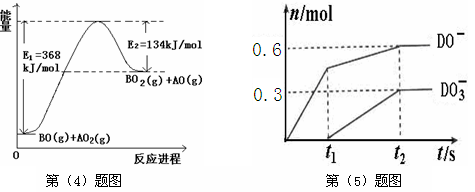
(5)C的最高价氧化物对应的水化物为M,M中含有的化学键类型为 。将一定量的D2通入一定浓度M的水溶液中,两者恰好完全反应时,生成物中有三种含D元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如上图所示。请写出t2时刻总反应方程式
X、Y、Z、W是元素周期表前四周期常见的四种元素,原子序数依次增大。X的单质既有σ键乂有π键,且X的第一电离能比其相邻元素都大,Y的电负性比X的小,其基态原子最外层的p电子是该层s电子的两倍,Z是前36号元素中原子半径最大的主族元素,W的一种核素的质量数是56,中子数是30。
(1) Y位于元素周期表第_______周期第_______族,W2+的核外电子排布式是______。
(2) X的氧化物XO2与H2O比较,熔点较高的是_______ (填化学式),Z的氢化物属于 晶体,Z2O2的化学键类型是_______(填编号)
| A.离子键 | B.极性共价键 | C.非极性共价键 | D.金属键 |
(4)在250C,101kPa下,W的单质在氧气中燃烧后恢复至原温度和压强,平均每转移1mol电子放出QkJ的热量,则W单质燃烧的热化学方程式是_______。

 作为燃料气,则接触面上发生的反应为______________________________。
作为燃料气,则接触面上发生的反应为______________________________。 作为燃料气,则接触面上发生的反应为________________________________。
作为燃料气,则接触面上发生的反应为________________________________。