题目内容
(15分)(1)碳、氮、氧的第一电离能大小顺序为 ,氧原子电子排布式为 。
(2)氨分子氮原子杂化类型 ,氨水中四种氢键哪一种是主要的 ,规律是什么? 。画出氢氟酸溶液中最主要氢键 。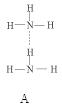
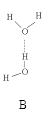
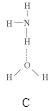
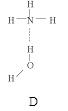
(3)DNA中四种碱基间通过氢键可能的配对方式,用虚线把氢键表示出来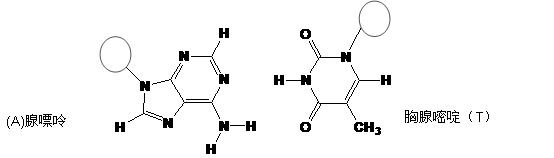

(4)试分析富马酸的K2大于其顺式异构体马来酸K2的原因。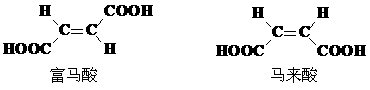
(5)下表是三种火箭推进剂的沸点,为什么火箭推进剂选择氮元素? 。
| 物质 | H2 | N2H4 | H2NN(CH3)2 |
| 沸点/℃ | -252.8 | 113.5 | ~116 |
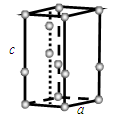
回答下列问题:
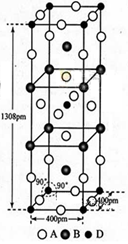
①计算晶胞中含有几个水分子。 ②计算冰的密度。
(1)氮>氧>碳 1s22s2p4
(2)sp3 D 极性键较强的氢和非金属性较弱的元素间形成氢键 O…H—F
(3)

(5)形成氢键,火箭载体减去了冷却系统的质量
 (6)①冰晶胞中含有水分子的个数为:
(6)①冰晶胞中含有水分子的个数为: 
解析

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
A、B、C、D、E为前四周期中原子序数依次增大的元素,相关的信息如下:
| 元素 | 相关信息 |
| A | A元素原子核外只有三个能级,且每个能级上含有相等的电子数 |
| B | 是空气中含量最丰富的元素 |
| C | 短周期中,单质C的金属性最强 |
| D | 基态原子第三能层上有7种运动状态不同的电子 |
| E | 一种核素的质量数为63,中子数为34 |
请用对应的元素符号回答下列问题:
(1)A与氢可形成一种的分子式为A2H4化合物,该分子中存在σ键与π键数目比为 。
(2)H—A、H—B两种共价键中,键能较大的是 ;H—A、H—D两种共价键中,键的极性较强的是
(3)E位于周期表中的位置是 ,单质E与B的最高价氧化物的水化物的稀溶液反应的离子方程式为 。
(4)根据下列能量变化示意图,请写出BO和AO2反应的热化学方程式 。

(5)C的最高价氧化物对应的水化物为M,M中含有的化学键类型为 。将一定量的D2通入一定浓度M的水溶液中,两者恰好完全反应时,生成物中有三种含D元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如上图所示。请写出t2时刻总反应方程式
下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号。
| X | Y | Z | |
| | R | | |
| | | W | |
| | | | J |
请回答下列问题(除特别说明外,凡涉及用元素回答的问题均用具体元素符号表示):
(1) 在化合物YZ2中Y的化合价为________;Y2-与Na+的半径大小为_______________;
(2) R原子的基态电子排布式为
__________________________________________________________________________;
(3)在X、Y、Z三种元素中,第一电离能由大到小的顺序是______________________;
(4)有一种酸HX3的酸性与醋酸相近,HX3溶液与NaOH溶液反应的离子方程式为___________________________________________。
(12分)根据下列某些短周期元素中元素性质回答问题。
| | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径/10 -10m | 0.37 | 1.86 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.52 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | | +3 | +4 | +5 | +7 | +1 | +5 | |
| 最低价态 | -1 | | -2 | | -4 | -3 | -1 | | -3 | -1 |
(2)元素①和⑨形成阳离子 ,其结构式为__________________。
(3)某元素R的原子半径为1.02×10 -10m ,它与钠形成Na2R2,其电子式是_________(R用元素符号表示)。
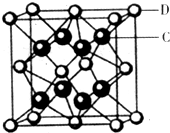
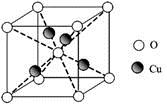
(4)元素②和⑦形成晶体的部分结构可用下图中的_________来表示(填序号)。

(5)①、③、⑨可以形成原子个数之比为4:3:2的中学常见无机化合物,该化合的水溶液显酸性的原因是_________________(用离子方程式表示),其水溶液中离子浓度由大到小的顺序是___________________。
下列各组物质中,化学键类型完全相同的是( )
A. 和 和 | B. 和 和 | C. 和 和 | D. 和 和 |