题目内容
13.某元素二价阴离子核外有10个电子,质量数为18,该元素原子的原子核中的中子数( )| A. | 8 | B. | 10 | C. | 12 | D. | 14 |
分析 根据阴离子中核内质子数=核外电子数-电荷数,中子数=质量数-质子数,据此分析解答.
解答 解:阴离子中核内质子数=核外电子数-电荷数=10-2=8,中子数=质量数-质子数=18-8=10,
故选B.
点评 本题考查核素的表示方法和质量数与质子数、中子数之间的关系,难度不大,明确离子的质子数和核外电子数的关系是解题的关键.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目
3.实验室可用如图所示装置制取的气体是( )
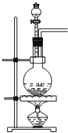

| A. | Cl2 | B. | C2H4 | C. | C2H2 | D. | CO2 |
4.表列出了前20号元素中的某些元素性质的有关数据:
(1)用元素符号标出它们在元素周期表中的对应位置:
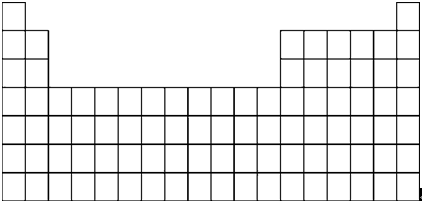
(2)在上面的元素周期表中,用斜线标出通常寻找催化剂材料的区域
(3)以上10种元素的原子中,最容易失去电子的是K(填元素符号);与H2最容易化合的非金属单质是氟气(写物质名称).
(4)用电子式表示元素③形成的氢化物过程
(5)写出上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的一种物质的分子式CCl4或PCl3.某元素R的原子半径为1.02×10-10m,该元素在周期表中位于第三周期第VIA族.
(6)写出④的最高价氧化物的水化物分别跟⑦和⑧的最高价氧化物的水化物反应的离子方程式.
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |

(2)在上面的元素周期表中,用斜线标出通常寻找催化剂材料的区域
(3)以上10种元素的原子中,最容易失去电子的是K(填元素符号);与H2最容易化合的非金属单质是氟气(写物质名称).
(4)用电子式表示元素③形成的氢化物过程

(5)写出上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的一种物质的分子式CCl4或PCl3.某元素R的原子半径为1.02×10-10m,该元素在周期表中位于第三周期第VIA族.
(6)写出④的最高价氧化物的水化物分别跟⑦和⑧的最高价氧化物的水化物反应的离子方程式.
1.短周期元素X、Y、Z、W、Q在元素周期表中的位置如图所示,其中X元素原子最外层电子数是最内层电子数的3倍,则下列说法正确的是( )
| X | Y | ||
| Z | W | Q |
| A. | X、W分别与钠形成的化合物摩尔质量相同,且每种化合物中阴阳离子数比为1:2 | |
| B. | 含X和Z元素的常见化合物为离子化合物 | |
| C. | 氧化物对应的水化物酸性:W<Q | |
| D. | 原子半径大小关系:Q>W>Z>Y |
8.从①P和S②Mg和Ca③Al和Si三组原子中,分别找出第一电离能较大的原子,将这3种原子的原子序数想家,其和是( )
| A. | 40 | B. | 41 | C. | 42 | D. | 48 |
18.某温度下完全分解下列化合物40g,产生O236g,此化合物是( )
| A. | 1H216O | B. | 1H218O | C. | 2H216O | D. | 2H218O |
5.下列关于乙二醇和丙三醇的说法中,不正确的是( )
| A. | 乙二醇的水溶液凝固点很低,可作汽车发动机的抗冻剂 | |
| B. | 丙三醇的沸点比乙二醇的沸点高,可用于配制化妆品 | |
| C. | 这两种多元醇都易溶于水,但难溶于有机溶剂 | |
| D. | 丙三醇可以制造炸药,乙二醇是制涤纶的主要原料 |
3.“莫斯科2009年7月28日电,27日夜间,位于莫斯科郊外的杜伯纳国际联合核研究所的专家们启动新元素合成实验,如果顺利的话,实验结束时将会合成门捷列夫元素周期表上的第117号新元素”.下列有关该元素的说法正确的是( )
| A. | 117 g该元素原子的物质的量为1 mol | |
| B. | 该元素一定为非金属元素 | |
| C. | 该元素在地球上的含量十分丰富 | |
| D. | 该元素的金属性可能比非金属性更明显 |
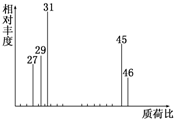 为了测定某有机物A的结构,做如下实验:
为了测定某有机物A的结构,做如下实验: