题目内容
2.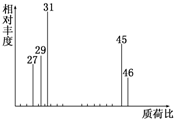 为了测定某有机物A的结构,做如下实验:
为了测定某有机物A的结构,做如下实验:①将2.3g该有机物完全燃烧,生成0.1mol CO2和2.7g水;
②用质谱仪测定其相对分子质量,得如图所示的质谱图;
试回答下列问题:
(1)有机物A的相对分子质量是46.
(2)有机物A的实验式是C2H6O.
(3)能否根据A的实验式确定A的分子式能(填“能”或“不能”);若能,则A的分子式是C2H6O,若不能,请说明原因.
分析 (1)根据质荷比可知,有机物A的相对分子质量;
(2)根据n=$\frac{m}{M}$计算生成的水的物质的量,计算碳元素、氢元素的质量,根据质量守恒判断有机物A是否含有氧元素,若含有氧元素,计算氧元素质量、氧原子物质的量,根据有机物A中C、H、O原子个数比值确定最简式;
(3)根据有机物的最简式中H原子说明是否饱和C原子的四价结构判断.
解答 解:(1)在A的质谱图中,最大质荷比为46,所以其相对分子质量也是46,故答案为:46;
(2)2.3 g该有机物中,n(C)=n(CO2)=0.1 mol,含有的碳原子的质量为m(C)=0.1 mol×12 g•mol-1=1.2 g,氢原子的物质的量为:n(H)=$\frac{2.7g}{18g/mol}$×2=0.3 mol,氢原子的质量为m(H)=0.3 mol×1 g•mol-1=0.3 g,该有机物中m(O)=2.3 g-1.2 g-0.3 g=0.8 g,氧元素的物质的量为n(O)=$\frac{0.8g}{16g/mol}$=0.05 mol,则n(C):n(H):n(O)=0.1 mol:0.3 mol:0.05 mol=2:6:1,所以A的实验式是C2H6O,
故答案为:C2H6O;
(3)该有机物的最简式为C2H6O,H原子已经饱和C原子的四价结构,最简式即为分子式,故答案为:能;C2H6O.
点评 本题考查有机物分子式与结构确定、同分异构体的书写等,难度中等,注意燃烧法利用原子守恒确定有机物的分子式,侧重对基础知识与学生综合能力考查,注意对有机谱图的简单认识.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
13.某元素二价阴离子核外有10个电子,质量数为18,该元素原子的原子核中的中子数( )
| A. | 8 | B. | 10 | C. | 12 | D. | 14 |
10.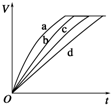 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体
积V的数据,根据数据绘制得到图,则曲线a、b、c、d所对应的实验组别可能是( )
 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到图,则曲线a、b、c、d所对应的实验组别可能是( )
| 组别 | c(HCl)/(mol•L-1) | 温度/(℃) | 状态 |
| 1 | 2.0 | 30 | 块状 |
| 2 | 2.5 | 30 | 块状 |
| 3 | 2.0 | 20 | 块状 |
| 4 | 2.5 | 30 | 粉末状 |
| A. | 4、3、2、1 | B. | 4、2、1、3 | C. | 3、4、2、1 | D. | 4、1、2、3 |
17.(1)在一固定容积的密闭容器中进行着如下反应:
CO2(g)+H2(g)?CO(g)+H2O(g) 其平衡常数K和温度t的关系如下:
(a)该反应平衡常数K的表达式为:$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$;
(b)当温度为850℃,在2L密闭容器中通入1.0mol CO2和1.0mol H2,则平衡后,CO2的转化率为50%.
(2)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-.这两步的能量变化示意图如下:

(a)第二步反应是放热反应(选填“放热”或“吸热”)
(b)1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是NH4+ (aq)+2O2(g)═NO3- (aq)+2H+(aq)+H2O(l)△H=-346 kJ/mol.
(3)已知:
①25℃时,测得HCN和NaCN的混合溶液的pH=11,则c(HCN)/c(CN-)=2.0×10-2.
②向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:CN-+CO2+H2O=HCN+HCO3-.
(4)已知:Ksp(CaCO3)=4.96×10-9,不考虑其它因素影响,现将0.40mol/L的Na2CO3溶液和0.20mol/L的CaCl2溶液等体积混合,则混合后溶液中Ca2+浓度为4.96×10-8mol/L.
CO2(g)+H2(g)?CO(g)+H2O(g) 其平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(b)当温度为850℃,在2L密闭容器中通入1.0mol CO2和1.0mol H2,则平衡后,CO2的转化率为50%.
(2)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-.这两步的能量变化示意图如下:

(a)第二步反应是放热反应(选填“放热”或“吸热”)
(b)1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是NH4+ (aq)+2O2(g)═NO3- (aq)+2H+(aq)+H2O(l)△H=-346 kJ/mol.
(3)已知:
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
②向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:CN-+CO2+H2O=HCN+HCO3-.
(4)已知:Ksp(CaCO3)=4.96×10-9,不考虑其它因素影响,现将0.40mol/L的Na2CO3溶液和0.20mol/L的CaCl2溶液等体积混合,则混合后溶液中Ca2+浓度为4.96×10-8mol/L.
14.向硫酸铜溶液中通入足量NH3后可得到深蓝色溶液[溶质为Cu(NH3)4SO4],再向所得溶液通入SO2至溶液呈微酸性发现有白色沉淀Q生成,反应方程式为:①2Cu(NH3)4SO4+3SO2+4H2O=2NH4CuSO3↓+3(NH4)2SO4.再将Q与足量的10mol/L硫酸混合微热,则会发生如下反应:②2NH4CuSO3+2H2SO4=Cu+(NH4)2SO4+2SO2+CuSO4+2H2O.对上述两个反应的有关分析中正确的是( )
| A. | ①是非氧化还原反应,而②是氧化还原反应 | |
| B. | 上述反应中SO2的作用只相当于催化剂 | |
| C. | 反应②中CuSO4是氧化产物 | |
| D. | 反应①中SO2发生还原反应 |
11.如表是部分短周期元素原子半径及主要化合价,根据表中信息,判断以下叙述不正确的是( )
| 元素代号 | K | L | M | Q | R | T | N |
| 原子半径/nm | 0.183 | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.152 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | +2 | -2 | +1 |
| A. | K、L、M三种元素的金属性逐渐减弱 | |
| B. | 在RCl2分子中,各原子均满足8电子的稳定结构 | |
| C. | Q元素的最高价氧化物为非电解质,其水溶液能够导电 | |
| D. | K在T单质中燃烧所形成的化合物中含有非极性共价键和离子键 |
12.X、Y、Z、W四种短周期元素在元素周期表中的相对位置如表所示,Z的单质是常见的半导体材料.下列说法正确的是( )
| X | ||
| Y | Z | W |
| A. | X、Z、W的简单氢化物的稳定性Z>W>X | |
| B. | X元素的单质在化学反应中只表现还原性 | |
| C. | X、Y的简单离子半径Y>X | |
| D. | Y、Z、X的最高价氧化物均能与NaOH溶液反应 |
 的分子式为C12H16O.
的分子式为C12H16O. 分子中,处于同一平面上的原子数最多可能有16个.
分子中,处于同一平面上的原子数最多可能有16个. 系统命名为4,4-二甲基-2-戊醇.
系统命名为4,4-二甲基-2-戊醇.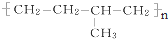 的单体为CH2=CH2、CH3-CH=CH2.
的单体为CH2=CH2、CH3-CH=CH2.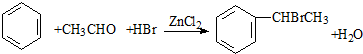 (卤烷基化反应)
(卤烷基化反应)
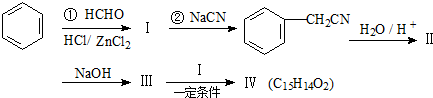
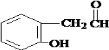 ,
,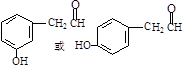 .
.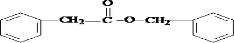 .
.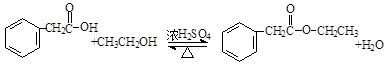 .
.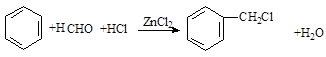 .
.