题目内容
8.从①P和S②Mg和Ca③Al和Si三组原子中,分别找出第一电离能较大的原子,将这3种原子的原子序数想家,其和是( )| A. | 40 | B. | 41 | C. | 42 | D. | 48 |
分析 同一主族元素的第一电离能随着原子序数的增大而减小,同一周期元素的第一电离能随着原子序数的增大而增大,注意同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的.
解答 解:①P和S属于同一周期元素且原子序数依次增大,但P处于第ⅤA族和S处于第ⅥA族,所以其第一电离能大小顺序是P>S;
②Mg和Ca属于同一主族元素且原子序数依次增大,同一主族元素的第一电离能随着原子序数的增大而减小,所以其第一电离能大小顺序是Mg>Ca;
③Al和Si属于同一周期元素且原子序数依次增大,同一周期元素的第一电离能随着原子序数的增大而呈增大趋势,所以其第一电离能大小顺序是Si>Al;
所以原子序数之和15+12+14=41,
故选B.
点评 本题考查了第一电离能大小的判断,难度不大,根据元素周期律来分析解答即可,注意同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的.

练习册系列答案
相关题目
19.已知同一碳原子连有两个羟基不稳定: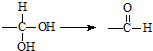 .有机物
.有机物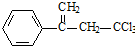 是选择性内吸传导性除草剂,俗称稗草烯,主要用于水稻田防除稗草,温度和湿度对药效影响大,温度高、湿度大药效发挥快.下列有关该有机物的说法不正确的是( )
是选择性内吸传导性除草剂,俗称稗草烯,主要用于水稻田防除稗草,温度和湿度对药效影响大,温度高、湿度大药效发挥快.下列有关该有机物的说法不正确的是( )
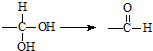 .有机物
.有机物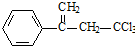 是选择性内吸传导性除草剂,俗称稗草烯,主要用于水稻田防除稗草,温度和湿度对药效影响大,温度高、湿度大药效发挥快.下列有关该有机物的说法不正确的是( )
是选择性内吸传导性除草剂,俗称稗草烯,主要用于水稻田防除稗草,温度和湿度对药效影响大,温度高、湿度大药效发挥快.下列有关该有机物的说法不正确的是( )| A. | 属于卤代烃,能使酸性高锰酸钾溶液和溴水褪色 | |
| B. | 该物质既有对映异构,也有顺反异构 | |
| C. | 在碱性条件下充分水解,可生成羧酸盐 | |
| D. | 1mol 该物质在一定条件下可与4molH2发生加成反应 |
16.原子结构为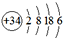 的元素,位于元素周期表的( )
的元素,位于元素周期表的( )
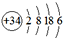 的元素,位于元素周期表的( )
的元素,位于元素周期表的( )| A. | 第六周期第Ⅳ族 | B. | 第四周期第Ⅵ族 | C. | 第六周期第ⅣA族 | D. | 第四周期第ⅥA族 |
3.下列说法正确的是( )
| A. | 有H、D、T与16O、17O、18O构成的过氧化氢分子的相对分子质量有36个 | |
| B. | H2、D2、T2互为同素异形体 | |
| C. | H2、D2、T2在相同条件下的密度比为1:2:3 | |
| D. | 氕、氘发生核聚变成其他元素,属于化学变化 |
13.某元素二价阴离子核外有10个电子,质量数为18,该元素原子的原子核中的中子数( )
| A. | 8 | B. | 10 | C. | 12 | D. | 14 |
17.(1)在一固定容积的密闭容器中进行着如下反应:
CO2(g)+H2(g)?CO(g)+H2O(g) 其平衡常数K和温度t的关系如下:
(a)该反应平衡常数K的表达式为:$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$;
(b)当温度为850℃,在2L密闭容器中通入1.0mol CO2和1.0mol H2,则平衡后,CO2的转化率为50%.
(2)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-.这两步的能量变化示意图如下:

(a)第二步反应是放热反应(选填“放热”或“吸热”)
(b)1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是NH4+ (aq)+2O2(g)═NO3- (aq)+2H+(aq)+H2O(l)△H=-346 kJ/mol.
(3)已知:
①25℃时,测得HCN和NaCN的混合溶液的pH=11,则c(HCN)/c(CN-)=2.0×10-2.
②向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:CN-+CO2+H2O=HCN+HCO3-.
(4)已知:Ksp(CaCO3)=4.96×10-9,不考虑其它因素影响,现将0.40mol/L的Na2CO3溶液和0.20mol/L的CaCl2溶液等体积混合,则混合后溶液中Ca2+浓度为4.96×10-8mol/L.
CO2(g)+H2(g)?CO(g)+H2O(g) 其平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(b)当温度为850℃,在2L密闭容器中通入1.0mol CO2和1.0mol H2,则平衡后,CO2的转化率为50%.
(2)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-.这两步的能量变化示意图如下:

(a)第二步反应是放热反应(选填“放热”或“吸热”)
(b)1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是NH4+ (aq)+2O2(g)═NO3- (aq)+2H+(aq)+H2O(l)△H=-346 kJ/mol.
(3)已知:
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
②向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:CN-+CO2+H2O=HCN+HCO3-.
(4)已知:Ksp(CaCO3)=4.96×10-9,不考虑其它因素影响,现将0.40mol/L的Na2CO3溶液和0.20mol/L的CaCl2溶液等体积混合,则混合后溶液中Ca2+浓度为4.96×10-8mol/L.
 .
. 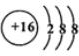 ;D与E能形成一种所有原子最外层均满足8电子的分子,该分子的结构式为S=C=S;D所在族元素的氢化物中,沸点最低的是H2S.
;D与E能形成一种所有原子最外层均满足8电子的分子,该分子的结构式为S=C=S;D所在族元素的氢化物中,沸点最低的是H2S.
 .
. .
.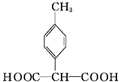 .
.