题目内容
1.短周期元素X、Y、Z、W、Q在元素周期表中的位置如图所示,其中X元素原子最外层电子数是最内层电子数的3倍,则下列说法正确的是( )| X | Y | ||
| Z | W | Q |
| A. | X、W分别与钠形成的化合物摩尔质量相同,且每种化合物中阴阳离子数比为1:2 | |
| B. | 含X和Z元素的常见化合物为离子化合物 | |
| C. | 氧化物对应的水化物酸性:W<Q | |
| D. | 原子半径大小关系:Q>W>Z>Y |
分析 由短周期元素在周期表中的位置可知,X、Y处于第二周期,Z、W、Q处于第三周期,X原子的最外层电子数是最内层电子数的3倍,最外层电子数为6,则X为O,可推知Y是F元素,Z是Si元素,W是S元素,Q是Cl元素,结合元素周期律及其单质化合物的性质来解答.
解答 解:由短周期元素在周期表中的位置可知,X、Y处于第二周期,Z、W、Q处于第三周期,X原子的最外层电子数是最内层电子数的3倍,最外层电子数为6,则X为O,可推知Y是F元素,Z是Si元素,W是S元素,Q是Cl元素.
A.O、S能与Na形成摩尔质量相同的化合物,分别为Na2O2、Na2S,且阴阳离子个数比都是1:2,故A正确;
B.含O与Si元素的常见化合物是二氧化硅,属于原子晶体,故B错误;
C.Cl的非金属性大于S,所以最高价氧化物的水化物的酸性Cl>Si,但未指明最高价氧化物的水化物时,不能确定,如次氯酸与硫酸相比,硫酸的酸性大于次氯酸,故C错误;
D.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径的大小关系是Z>W>Q>Y,故D错误,
故选A.
点评 本题考查元素的判断、元素周期律的应用,难度不大,W为推断的突破口,注意熟练掌握元素周期表结构与元素周期律,有利于基础知识的巩固.

练习册系列答案
相关题目
11.下列做法中符合“绿色化学”思想的是( )
| A. | CO2不是大气污染物,所以可以大量排放到空气中 | |
| B. | 以无磷洗涤剂代替含磷洗涤剂 | |
| C. | 实验后的有毒有害物质应分类收集,统一处理 | |
| D. | 在通风橱中制取氯气时不用NaOH溶液吸收尾气 |
9.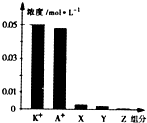 常温下,0.1mol•L-1一元酸HA与等浓度KOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.1mol•L-1一元酸HA与等浓度KOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
 常温下,0.1mol•L-1一元酸HA与等浓度KOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.1mol•L-1一元酸HA与等浓度KOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )| A. | 该混合溶液pH=7.0 | B. | 原HA溶液中:c(HA)>c(H+)>c(A-) | ||
| C. | 图中X表示HA,Y表示OH-,Z表示H+ | D. | 混合溶液中:c(X)+x(A-)=c(K+) |
16.原子结构为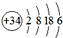 的元素,位于元素周期表的( )
的元素,位于元素周期表的( )
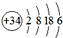 的元素,位于元素周期表的( )
的元素,位于元素周期表的( )| A. | 第六周期第Ⅳ族 | B. | 第四周期第Ⅵ族 | C. | 第六周期第ⅣA族 | D. | 第四周期第ⅥA族 |
13.某元素二价阴离子核外有10个电子,质量数为18,该元素原子的原子核中的中子数( )
| A. | 8 | B. | 10 | C. | 12 | D. | 14 |
10. 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体
积V的数据,根据数据绘制得到图,则曲线a、b、c、d所对应的实验组别可能是( )
 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到图,则曲线a、b、c、d所对应的实验组别可能是( )
| 组别 | c(HCl)/(mol•L-1) | 温度/(℃) | 状态 |
| 1 | 2.0 | 30 | 块状 |
| 2 | 2.5 | 30 | 块状 |
| 3 | 2.0 | 20 | 块状 |
| 4 | 2.5 | 30 | 粉末状 |
| A. | 4、3、2、1 | B. | 4、2、1、3 | C. | 3、4、2、1 | D. | 4、1、2、3 |
11.如表是部分短周期元素原子半径及主要化合价,根据表中信息,判断以下叙述不正确的是( )
| 元素代号 | K | L | M | Q | R | T | N |
| 原子半径/nm | 0.183 | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.152 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | +2 | -2 | +1 |
| A. | K、L、M三种元素的金属性逐渐减弱 | |
| B. | 在RCl2分子中,各原子均满足8电子的稳定结构 | |
| C. | Q元素的最高价氧化物为非电解质,其水溶液能够导电 | |
| D. | K在T单质中燃烧所形成的化合物中含有非极性共价键和离子键 |
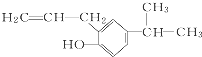 的分子式为C12H16O.
的分子式为C12H16O.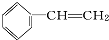 分子中,处于同一平面上的原子数最多可能有16个.
分子中,处于同一平面上的原子数最多可能有16个. 系统命名为4,4-二甲基-2-戊醇.
系统命名为4,4-二甲基-2-戊醇. 的单体为CH2=CH2、CH3-CH=CH2.
的单体为CH2=CH2、CH3-CH=CH2. ,A在周期表中的位置第一周期第ⅠA族.
,A在周期表中的位置第一周期第ⅠA族.