题目内容
18.某温度下完全分解下列化合物40g,产生O236g,此化合物是( )| A. | 1H216O | B. | 1H218O | C. | 2H216O | D. | 2H218O |
分析 根据质量守恒定律知,水分解生成氢气的质量=40g-36g=4g,设氧气的摩尔质量为xg/mol、氢气的摩尔质量为yg/mol,氧气的物质的量与氢气的物质的量之比为=$\frac{36g}{xg/mol}$:$\frac{4g}{yg/mol}$=1:2,据此分析解答.
解答 解:根据质量守恒定律知,水分解生成氢气的质量=40g-36g=4g,设氧气的摩尔质量为xg/mol、氢气的摩尔质量为yg/mol,氧气的物质的量与氢气的物质的量之比为=$\frac{36g}{xg/mol}$:$\frac{4g}{yg/mol}$=1:2,x:y=18,则氧核素为18O、氢核素为1H,其形成的水为1H218O,故选B.
点评 本题考查化学方程式的有关计算,侧重分析计算能力考查,明确分子构成及物质之间关系是解本题关键,题目难度不大,注意核素相对原子质量与其摩尔质量在数值上相等.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案
相关题目
8.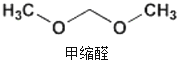 2015年央视3.15晚会曝光了山东省东营市、滨州市许多不法厂商,把一部分90号的汽油配上大量的石脑油、芳烃、甲缩醛等调和成“93号汽油”.查资料知,甲缩醛是一种无色易挥发可燃液体,主要用于生产杀虫剂、皮革和汽车上光剂等,是现行的车用汽油国家标准中不得添加的有害物质,它易造成汽车线路漏油,对动物有麻醉作用,也有一定毒性.下列对其说法中正确的是( )
2015年央视3.15晚会曝光了山东省东营市、滨州市许多不法厂商,把一部分90号的汽油配上大量的石脑油、芳烃、甲缩醛等调和成“93号汽油”.查资料知,甲缩醛是一种无色易挥发可燃液体,主要用于生产杀虫剂、皮革和汽车上光剂等,是现行的车用汽油国家标准中不得添加的有害物质,它易造成汽车线路漏油,对动物有麻醉作用,也有一定毒性.下列对其说法中正确的是( )
 2015年央视3.15晚会曝光了山东省东营市、滨州市许多不法厂商,把一部分90号的汽油配上大量的石脑油、芳烃、甲缩醛等调和成“93号汽油”.查资料知,甲缩醛是一种无色易挥发可燃液体,主要用于生产杀虫剂、皮革和汽车上光剂等,是现行的车用汽油国家标准中不得添加的有害物质,它易造成汽车线路漏油,对动物有麻醉作用,也有一定毒性.下列对其说法中正确的是( )
2015年央视3.15晚会曝光了山东省东营市、滨州市许多不法厂商,把一部分90号的汽油配上大量的石脑油、芳烃、甲缩醛等调和成“93号汽油”.查资料知,甲缩醛是一种无色易挥发可燃液体,主要用于生产杀虫剂、皮革和汽车上光剂等,是现行的车用汽油国家标准中不得添加的有害物质,它易造成汽车线路漏油,对动物有麻醉作用,也有一定毒性.下列对其说法中正确的是( )| A. | 甲缩醛和乙醛互为同系物 | |
| B. | 用甲醇和甲醛生产甲缩醛的反应为加成反应 | |
| C. | 等物质的量的甲缩醛和丙炔完全燃烧的耗氧量相同 | |
| D. | 用甲缩醛生产杀虫剂、皮革和汽车上光剂等,均是利用了它的毒性 |
9.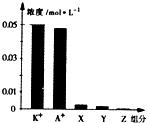 常温下,0.1mol•L-1一元酸HA与等浓度KOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.1mol•L-1一元酸HA与等浓度KOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
 常温下,0.1mol•L-1一元酸HA与等浓度KOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.1mol•L-1一元酸HA与等浓度KOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )| A. | 该混合溶液pH=7.0 | B. | 原HA溶液中:c(HA)>c(H+)>c(A-) | ||
| C. | 图中X表示HA,Y表示OH-,Z表示H+ | D. | 混合溶液中:c(X)+x(A-)=c(K+) |
13.某元素二价阴离子核外有10个电子,质量数为18,该元素原子的原子核中的中子数( )
| A. | 8 | B. | 10 | C. | 12 | D. | 14 |
3.对二甲苯是苯的同系物,也是一种化学工业的重要原料,下列说法正确的是( )
| A. | 对二甲苯的一氯代物有三种 | |
| B. | 对二甲苯的所有原子可能在同一平面内 | |
| C. | 对二甲苯能使溴水和酸性高锰酸钾因发生化学反应而褪色 | |
| D. | 在一定条件下,对二甲苯能发生氧化反应、还原反应、取代反应、加成反应 |
10.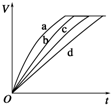 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体
积V的数据,根据数据绘制得到图,则曲线a、b、c、d所对应的实验组别可能是( )
 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到图,则曲线a、b、c、d所对应的实验组别可能是( )
| 组别 | c(HCl)/(mol•L-1) | 温度/(℃) | 状态 |
| 1 | 2.0 | 30 | 块状 |
| 2 | 2.5 | 30 | 块状 |
| 3 | 2.0 | 20 | 块状 |
| 4 | 2.5 | 30 | 粉末状 |
| A. | 4、3、2、1 | B. | 4、2、1、3 | C. | 3、4、2、1 | D. | 4、1、2、3 |
8. 当今世界,能源的发展日益成为全世界、全人类共同关心的问题.
当今世界,能源的发展日益成为全世界、全人类共同关心的问题.
(1)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如表所示:
①请根据上述信息,写出A的核外电子排布式:1s22s2.
②某同学根据上述信息,推断B的核外电子排布如图1所示,该同学所画的电子排布图违背了能量最低原理.
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.
①已知金刚石中碳碳键的键长为154.45pm,C60中碳碳键的键长为145pm和140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由否或不正确,理由:C60是分子晶体,金刚石是原子晶体,熔化时C60破坏分子间作用力而金刚石破坏共价键,所以C60的沸点低于金刚石.
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体.该物质中K原子和C60分子的个数比为3:1.
③继C60后,科学家又合成Si60、N60,请比较C、Si、N原子电负性由大到小的顺序N>C>Si.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则一个Si60分子中所含π键的数目为30.
 当今世界,能源的发展日益成为全世界、全人类共同关心的问题.
当今世界,能源的发展日益成为全世界、全人类共同关心的问题.(1)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如表所示:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 899 | 1 757 | 14 840 | 21 000 |
| B | 738 | 1 451 | 7 733 | 10 540 |
②某同学根据上述信息,推断B的核外电子排布如图1所示,该同学所画的电子排布图违背了能量最低原理.
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.
①已知金刚石中碳碳键的键长为154.45pm,C60中碳碳键的键长为145pm和140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由否或不正确,理由:C60是分子晶体,金刚石是原子晶体,熔化时C60破坏分子间作用力而金刚石破坏共价键,所以C60的沸点低于金刚石.
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体.该物质中K原子和C60分子的个数比为3:1.
③继C60后,科学家又合成Si60、N60,请比较C、Si、N原子电负性由大到小的顺序N>C>Si.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则一个Si60分子中所含π键的数目为30.
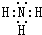 ,A在周期表中的位置第一周期第ⅠA族.
,A在周期表中的位置第一周期第ⅠA族.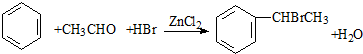 (卤烷基化反应)
(卤烷基化反应)
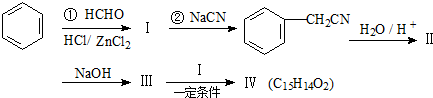
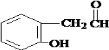 ,
,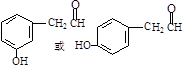 .
.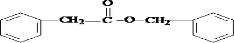 .
.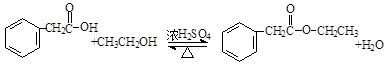 .
.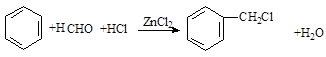 .
.