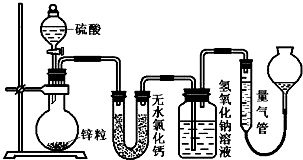
题目内容
9.常温下,下图是用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/LHA溶液所得到滴定曲线.下列相关的说法错误的是(忽略滴定前后体积变化)( )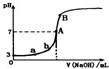
| A. | 由图可知HA是一种弱酸,且Ka=1.0×10-5 | |
| B. | 水电离出的氢离子浓度:a<b | |
| C. | 当NaOH溶液的体积为10.00mL时,有:c(A-)+c(OH-)=c(H+)+c(HA) | |
| D. | B点溶液中的离子浓度关系为:c(Na+)>c(A-)>c(OH-)>c(H+) |
分析 A.根据图象可知,0.1000mol/L的HA溶液的pH=3,说明HA在溶液中部分电离出氢离子;
B.a、b两点都为酸性溶液,氢离子浓度越大,水的电离程度越小;
C.反应后溶质为等浓度的HA和NaA,HA的电离程度大于A-的水解程度,混合液为酸性,则c(OH-)<c(H+),结合电荷守恒、物料守恒分析;
D.B点溶液为碱性,则c(OH-)>c(H+),结合电荷守恒判断各离子浓度.
解答 解:A.结合图象曲线可知,0.1000mol/L的HA溶液的pH=3,则HA在溶液中部分电离出氢离子,为弱酸;0.1000mol/L的HA溶液中氢离子浓度为0.001mol/L,A-离子浓度约为0.001mol/L,则Ka=$\frac{0.001×0.001}{0.1000}$=1.0×10-5,故A正确;
B.a、b两点为酸性溶液,且氢离子浓度a>b,溶液中的氢氧根离子是水电离的,则溶液中水电离的氢离子浓度:a<b,故正确;
C.当NaOH溶液的体积为10.00mL时,反应后溶质为有:等浓度的HA和NaA,HA的电离程度大于A-的水解程度,混合液为酸性,则c(OH-)<c(H+),结合物料守恒可知:c(A-)>c(Na+)>c(HA),根据电荷守恒可得:c(A-)+c(OH-)>c(H+)+c(HA),故C错误;
D.B点溶液为碱性,则:c(OH-)>c(H+),根据电荷守恒可知:c(Na+)>c(A-),则溶液中离子浓度大小为:c(Na+)>c(A-)>c(OH-)>c(H+),故D正确;
故选C.
点评 本题考查了酸碱混合的定性判断、离子浓度定性比较,题目难度中等,注意掌握酸碱混合的定性判断方法,明确电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列说法正确的是( )
| A. | 27gAl与足量浓硫酸混合,产生气体33.6L(标况) | |
| B. | 1molSiO2与C完全反应,生成标准状况气体44.8L | |
| C. | 电解精炼Cu时,阳极每溶解12.8gCu,阴极析出0.2molCu | |
| D. | 1mol/L的某一元酸溶液,测得pH=3,溶液中c(OH-)一定为1×10-11 |
17.常温下,一元酸HA溶液和NaOH溶液等体积混合(忽略体积变化),实验数据如下表下列判断正确的是( )
| 实验编号 | 起始浓度/mol•L-1 | 反应后溶液的pH | |
| c(HA) | c(NaOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | X | 0.2 | 7 |
| ③ | 0.2 | 0.1 | 4.8 |
| ④ | 0.1 | 0.2 | y |
| A. | 实验①反应后的溶液中:c(HA)约为$\frac{{K}_{W}}{1×1{0}^{-9}}$mol•L-1 | |
| B. | 实验②反应后的溶液中:c(HA)>c(Na+)=c(A-)>c(H+)=c(OH-) | |
| C. | 实验③反应后的溶液中:c(HA)+c(H+)=c(OH-)+c(A-) | |
| D. | 实验④反应后的溶液中:c(OH-)-c(H+)-c(HA)=0.05mol•L-1 |
4.下列操作能促进水的电离,且使溶液的pH>7的是( )
| A. | 将纯水加热到90℃ | B. | 向水中加少量Na2CO3溶液 | ||
| C. | 向水中加少量NaOH溶液 | D. | 向水中加少量FeCl3溶液 |
14.NA表示阿伏加德罗常数.下列说法正确的是( )
| A. | 常温常压下,8 g O2与8 g O3均含有4 NA个电子 | |
| B. | 标准状况下,2.24 L SO3的分子数为0.1 NA | |
| C. | 1L 1mol•L-1盐酸中含有NA个HCl分子 | |
| D. | 0.1 mol Fe与足量浓HNO3反应,转移电子数为0.3 NA |
1.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 元素C、D的最高价氧化物对应的水化物之间不能发生反应 | |
| C. | 工业上常用电解法制备元素C、D、E的单质 | |
| D. | 化合物AE与CE有相同类型的化学键 |
18.W、X、Y、Z四种元素是原子序数依次增大的短周期主族元素,已知:①四种元素的电子层数之和等于10,且它们是连续的四种主族元素;②四种元素的原子,其半径最大的是X原子.下列说法正确的是( )
| A. | W和X均位于第二周期 | B. | Y和Z分别是Al和Si | ||
| C. | W和X分别是O和F | D. | Z的金属性可能比X强 |
16.已知XO32-有42个电子,有关X原子的描述正确的是( )
| A. | X原子核外有16个电子 | |
| B. | XO32-有42个质子 | |
| C. | X的氧化物对应的水化物是一种强酸 | |
| D. | X为金属元素 |