题目内容
14.NA表示阿伏加德罗常数.下列说法正确的是( )| A. | 常温常压下,8 g O2与8 g O3均含有4 NA个电子 | |
| B. | 标准状况下,2.24 L SO3的分子数为0.1 NA | |
| C. | 1L 1mol•L-1盐酸中含有NA个HCl分子 | |
| D. | 0.1 mol Fe与足量浓HNO3反应,转移电子数为0.3 NA |
分析 A.氧气和臭氧分子中都只含有氧原子,8g二者的分子中都含有8g氧原子,含有0.5mol氧原子,含有4mol电子;
B.标准状况下,三氧化硫的状态不是气体;
C.氯化氢为强电解质,在溶液中完全电离,溶液中不存在氯化氢分子;
D.铁与浓硝酸在常温下发生钝化,无法计算转移的电子数.
解答 解:A.8g氧气和8g臭氧中都含有8g 氧原子,含有氧原子的物质的量为0.5mol,含有4mol电子,二者均含有4NA个电子,故A正确;
B.标况下三氧化硫不是气体,不能使用标况下的气体摩尔体积计算其物质的量,故B错误;
C.氯化氢为强电解质,盐酸中不存在氯化氢分子,故C错误;
D.铁与浓硝酸在常温下发生钝化现象,阻止了反应的继续进行,无法计算转移的电子数,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的计算和判断,题目难度中等,注意明确标况下三氧化硫、氟化氢、乙醇、水等物质的状态不是气体,熟练掌握物质的量与摩尔质量、阿伏伽德罗常数等物理量之间的关系,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
5.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | NaHSO3溶液:c(OH-)=c(HSO3-)+c(H+)+c(H2SO3) | |
| B. | CuSO4•(NH4)2SO4•6H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>C(OH-) | |
| C. | 氯气溶于水达到平衡后,若其他条件不变加入CaCO3固体,$\frac{c({H}^{+})}{c(HClO)}$增加 | |
| D. | NaSiO3溶液加水稀释后,恢复至原温度,pH和KW均减小 |
2.下列推论正确的是( )
| A. | S(g)+O2(g)=SO2(g)△H1,S(s)+O2(g)=SO2(g)△H2,则△H1>△H2 | |
| B. | NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4 kJ/mol,则含20 g NaOH的稀溶液与稀盐酸完反应,放出的热量为28.7 kJ | |
| C. | C(石墨,s)=C(金刚石,s)△H=+1.9 kJ/mol,则由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定 | |
| D. | 2C(s)+O2(g)=2CO(g)△H=-221 kJ/mol,则碳的燃烧热等于 110.5 kJ/mol |
9.常温下,下图是用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/LHA溶液所得到滴定曲线.下列相关的说法错误的是(忽略滴定前后体积变化)( )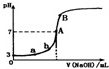

| A. | 由图可知HA是一种弱酸,且Ka=1.0×10-5 | |
| B. | 水电离出的氢离子浓度:a<b | |
| C. | 当NaOH溶液的体积为10.00mL时,有:c(A-)+c(OH-)=c(H+)+c(HA) | |
| D. | B点溶液中的离子浓度关系为:c(Na+)>c(A-)>c(OH-)>c(H+) |
19.25℃时0.1mol/L的硫化钠含S组份φ%(以物质的量计算)分布图如下,下列结论正确的是( )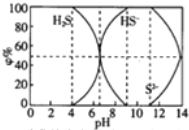

| A. | 当c(HS-)>c(S2-)时,溶液一定显酸性 | |
| B. | 当pH=7时,溶液中有c(Na+)=c(HS-)+2c(S2-)+c(H2S) | |
| C. | 当4<pH时,向其中滴加0.1mol/L CuSO4都有CuS沉淀(Kφ(CuS)=6.3×10-36) | |
| D. | 当pH=9时,溶液中有c(H+)=c(OH-)+c(HS-) |
3.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 通入过量SO2气体后的溶液:H+、Ca2+、Fe3+、N03- | |
| C. | 通入足量CO2的溶液:H+、NH4+、Al3+、SO42- | |
| D. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
1.下列关于离子化合物的叙述错误的是( )
| A. | 离子化合物中都含有离子键 | |
| B. | 离子化合物中可能含有共价键 | |
| C. | 在熔融状态下可以导电的化合物一定是离子化合物 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
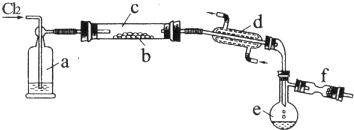
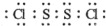 .
.