题目内容
20.下列说法正确的是( )| A. | 27gAl与足量浓硫酸混合,产生气体33.6L(标况) | |
| B. | 1molSiO2与C完全反应,生成标准状况气体44.8L | |
| C. | 电解精炼Cu时,阳极每溶解12.8gCu,阴极析出0.2molCu | |
| D. | 1mol/L的某一元酸溶液,测得pH=3,溶液中c(OH-)一定为1×10-11 |
分析 A、Al与浓硫酸发生钝化现象;
B、根据方程式:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO,来求解;
C、阳极材料为粗铜,有比铜活泼的金属先放电,所以阳极减少的质量与阴极增加的质量不相等;
D、如果是常温下Kw=1×10-14,1mol/L的某一元酸溶液,测得pH=3,溶液中c(OH-)一定为1×10-11.
解答 解:A、Al与浓硫酸发生钝化现象,所以产生气体为0,故A错误;
B、根据方程式:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO,1molSiO2与C完全反应,生成气体为2mol,标准状况气体体积为44.8L,故B正确;
C、阳极材料为粗铜,有比铜活泼的金属先放电,所以阳极减少的质量与阴极增加的质量不相等,故C错误;
D、如果是常温下Kw=1×10-14,1mol/L的某一元酸溶液,测得pH=3,溶液中c(OH-)一定为1×10-11,温度不知,无法求解,故D错误;
故选B.
点评 本题考查铝与硫酸反应、由方程式求气体的体积、精炼铜和水的离子积常数等知识,综合性强,比较容易.

练习册系列答案
相关题目
4.下列说法正确的是( )
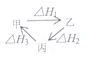

| A. | 甲、乙、丙三物质转化如图所示,则△H1=△H2+△H3 | |
| B. | 1molCO完全燃烧生成稳定氧化物放出热量为283.0KJ,则2 CO2(g)=2 CO(g)+O2(g),△H=+566.0KJ•mol-1 | |
| C. | 若N2(g)+3H2(g)?2NH3(g),△H=-92.4KJ•mol-1,故在某容器中充入1mol N2与3molH2充分反应后,放出的热量为92.4KJ | |
| D. | 常温下,稀HCl和稀NaOH溶液反应生成1molH2O放出热量为57.3 KJ,其热化学方程式为HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(aq),△H=-57.3KJ |
11.常见有机反应类型有:①取代反应 ②加成反应 ③消去反应 ④酯化反应 ⑤加聚反应 ⑥氧化反应 ⑦还原反应,其中可能在有机分子中引入羟基的反应类型是( )
| A. | ①②④ | B. | ⑤⑥⑦ | C. | ①②⑦ | D. | ③④⑤ |
8.下列有关有机物的组成和结构的说法不正确的是( )
| A. | 利用核磁共振氢谱可以鉴别乙醇和二甲醚 | |
| B. |  的一氯代物有4种 的一氯代物有4种 | |
| C. | 金刚烷( )分子中含有4个 )分子中含有4个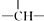 | |
| D. | 环戊二烯 (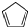 )分子中最多有9个原子在同一平面上 )分子中最多有9个原子在同一平面上 |
15.断肠草(Gelsemium)为中国古代九大毒药之一,据记载能“见血封喉”,现代查明它是葫蔓藤科植物葫蔓藤,其中的毒素很多,下列是分离出的四种毒素的结构式,下列推断正确的是( )


| A. | ①和②、③与④分别互为同分异构体 | |
| B. | ①、③互为同系物 | |
| C. | ①、②、③、④均能与氢氧化钠溶液反应 | |
| D. | 等物质的量的②、④分别在足量氧气中完全燃烧,前者消耗氧气比后者少 |
5.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | NaHSO3溶液:c(OH-)=c(HSO3-)+c(H+)+c(H2SO3) | |
| B. | CuSO4•(NH4)2SO4•6H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>C(OH-) | |
| C. | 氯气溶于水达到平衡后,若其他条件不变加入CaCO3固体,$\frac{c({H}^{+})}{c(HClO)}$增加 | |
| D. | NaSiO3溶液加水稀释后,恢复至原温度,pH和KW均减小 |
12.C1O2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得C1O2:
2KClO3+H2C2O4+H2SO4$\frac{\underline{\;加热\;}}{\;}$2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法中正确的是( )
2KClO3+H2C2O4+H2SO4$\frac{\underline{\;加热\;}}{\;}$2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法中正确的是( )
| A. | KClO3在反应中是氧化剂 | |
| B. | 1mol KClO3参加反应,在标准状况下能得到22.4L气体 | |
| C. | 在反应中H2C2O4既不是氧化剂也不是还原剂 | |
| D. | 1mol KClO3参加反应有1mol电子转移 |
9.常温下,下图是用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/LHA溶液所得到滴定曲线.下列相关的说法错误的是(忽略滴定前后体积变化)( )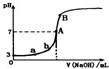

| A. | 由图可知HA是一种弱酸,且Ka=1.0×10-5 | |
| B. | 水电离出的氢离子浓度:a<b | |
| C. | 当NaOH溶液的体积为10.00mL时,有:c(A-)+c(OH-)=c(H+)+c(HA) | |
| D. | B点溶液中的离子浓度关系为:c(Na+)>c(A-)>c(OH-)>c(H+) |
 CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器I、II、III,在I中充入1molCO和1molH2O,在II中充入1molCO2和1molH2,在III中充入2molCO和2molH2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器I、II、III,在I中充入1molCO和1molH2O,在II中充入1molCO2和1molH2,在III中充入2molCO和2molH2O,700℃条件下开始反应。达到平衡时,下列说法正确的是